您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-01-18 12:15
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
1.和铂医药干眼病新药III期临床积极。和铂医药特那西普(HBM9036)滴眼液在中国用于治疗中重度干眼症(DED)的注册性III期临床完成首次期中分析。截至2021年12月28日,该试验共187例受试者完成关键疗效终点评估。基于观察到的疗效趋势和良好的安全性,独立数据监察委员会建议试验按现行方案继续进行。HBM9036是HanAll Biopharma开发的一款全球创新型的肿瘤坏死因子 (TNF) 受体-1 片段型药物。
2.加科思Aurora A抑制剂在美获批临床。加科思自主研发首创新药JAB-2485获FDA批准,即将在美国开展针对多种晚期实体瘤的I/IIa期临床试验。JAB-2485是一种高选择性小分子Aurora A抑制剂,在细胞水平可以抑制Aurora A活性,诱导细胞凋亡,抑制肿瘤生长。目前全球尚无同类产品获批,JAB-2485是第三家在美国进行临床试验的Aurora A抑制剂,有潜力为小细胞肺癌、三阴乳腺癌等肿瘤患者带来治疗获益。
3.渤健BDCA2单抗在华获批临床。渤健BDCA2靶向单抗BIIB059获国家药监局临床试验默示许可,拟开发用于正在接受非生物制剂标准疗法的成人活动期系统性红斑狼疮(SLE)。此前公布在ACR2020年会上的Ⅱ期临床LILAC结果显示,与安慰剂相比,BIIB059组患者第24周时疾病活跃总关节计数显著减少,而且安全性和耐受性良好。目前BIIB059正在两项Ⅲ期临床(TOPAZ-1和TOPAZ-2)中接受评估。
4.广州雷恩康亚GNP报IND。广州雷恩康亚生物自主研发的化学1类新药注射用GNP的临床试验申请获CDE受理,推测拟用于治疗肺动脉高压相关适应症或心衰合并肺动脉高压。GNP是从东非绿曼巴蛇的毒腺组织中分离得到的一种利钠肽,具有与其他利钠肽相同的核心结构:由17个氨基酸形成的通过一对半胱氨酸二硫键连接的环状结构。临床研究显示GNP具有良好的排钠、利尿与血管扩张的生物活性。
5.先声PRMT5抑制剂报IND。先声药业自主研发的抗肿瘤创新机制PRMT5抑制剂SCR-6920胶囊的临床试验申请获CDE受理,拟用于晚期恶性肿瘤的治疗。SCR-6920靶向合成致死基因中的甲硫腺苷磷酸化酶 (MTAP)/PRMT。在临床前研究中,SCR-6920已在体外展现出对多种血液瘤和实体瘤细胞的增殖抑制活性,且单药能显著抑制多个小鼠CDX模型中的肿瘤生长;并具有良好跨种属药代动力学性质,安全性较好,治疗窗大。
国际药讯
1.巴瑞替尼获WHO推荐用于新冠重症患者。世卫组织(WHO)国际指南制定小组推荐礼来JAK1/2抑制剂巴瑞替尼与皮质类固醇联用,用于治疗严重或危重症的新冠患者。世卫组织认为,这一联合方案可以提高患者的生存率,并减少患者对通气的需求,而且也没有观察到不良反应的增加。在美国,FDA此前已授予巴瑞替尼紧急使用授权,与瑞德西韦联用或单药治疗COVID-19住院患者。
2.英国NICE批准艾伯维Rinvoq治疗PsA。英国国家健康与护理卓越研究所(NICE)发布最终评估决定,推荐批准艾伯维(AbbVie)JAK抑制剂Rinvoq(upadacitinib)单独使用,或与甲氨蝶呤联合使用,用于治疗对抗风湿药物(DMARD)反应不佳或不能耐受的成人活动性银屑病关节炎(PsA)。值得一提的是,该疗法在一周前刚刚向美国和欧洲的监管机构提交了新适应症申请,用于治疗放射学阴性中轴型脊柱关节炎(nr-axSpA)。
3.FDA批准首个动物用抗体药。FDA日前批准动物制药公司Zoetis研发的NGF抗体frunevetmab的上市申请,用于治疗猫骨关节炎疼痛。这也是FDA批准的首个动物用抗体药。Zoetis原为辉瑞的动物保健部门,于2021年分拆出来,中文名为硕腾。Zoetis用于犬的NGF抗体bedinvetmab已获欧盟批准上市。辉瑞用于人的NGF抗体Tanezumab的上市申请遭FDA拒绝,理由是基于安全性的担忧。
4.FIC干眼症眼药水Ⅱ期临床积极。Aldeyra公司开发的新型小分子RASP抑制剂reproxalap,在治疗干眼症患者的Ⅱ期临床中获得积极顶线数据。与活性对照组相比,reproxalap治疗组患者报告的眼部不适(p=0.002)和瘙痒症状(p=0.01)评分都显著更低;试验中未观察到安全性信号。目前这款滴眼液正在关键性Ⅲ期临床中接受评估,预计在今年年中获得结果。
5.安进与BridgeBio开展联合用药研究。BridgeBio公司新型SHP2抑制剂BBP-398拟与安进已获批KRASG12C抑制剂Lumakras(sotorasib)开展一项Ⅰ/Ⅱ期研究,评估联合用药用于携带KRAS G12C突变的晚期实体瘤的安全性、耐受性、药代动力学、药效学和初步疗效。大约17%的恶性实体瘤发生KRAS突变。BBP-398单药或BBP-398+Lumakras组合有潜力阻止肿瘤发生及过度活跃的细胞增殖,可能是治疗KRAS G12C突变患者的一种潜在疗法。
6.阿斯利康达成两项研发合作。阿斯利康宣布与Scorpion Therapeutics将利用后者的整合发现平台,针对难于成药的转录因子合作开发多达3个抗癌创新候选疗法。根据协议,Scorpion将获得7500万美元前期付款和里程碑潜在付款。阿斯利康同时宣布扩展与BenevolentAI公司的研发协议,利用该公司AI药物发现平台加快针对系统性红斑狼疮和心力衰竭的新药开发。此前BenevolentAI已为阿斯利康针对慢性肾病和特发性肺纤维化开发了两个创新靶点候选疗法,两款候选疗法现已纳入阿斯利康的研发管线。
7.武田AD候选药物IND遭拒。FDA拒绝Denali与武田合作开发的阿尔茨海默病治疗药物DNL919进入临床试验。DNL919是一种抗体运输工具(ATV),旨在激活TREM2,以达到改善被认为是“大脑的常驻免疫细胞”的小胶质细胞功能。TREM2受体功能的丧失与阿尔茨海默病的额风险增加有关。按照原计划,DNL919今年上半年进入临床,并计划在下半年提供安全性和生物标志物数据。
医药热点
1.河南省人民医院挂牌郑州大学附属医院。1月7日,河南省教育厅、卫健委联合发布2021年第二批临床教育基地认定名单,河南省人民医院被正式认定为郑州大学的附属医院,同时增名郑州大学人民医院。公开资料显示,河南省人民医院由1904年创办的开封“福音医院”发展而来,1950年更名为河南省人民医院。该院本部开放床位3900张,ICU床位249张,拥有12个国家临床重点专科。
2.进京政策有变。北京市16日动态发布最新进返京政策,在进返京须持48小时内核酸检测阴性证明和“北京健康宝”绿码的基础上,自2022年1月22日零时起至3月底,进返京人员在抵京后72小时内需进行一次核酸检测,通勤人员按照现有政策规定继续执行。1月15日,北京市海淀区报告一例本土确诊病例,经基因序列显示病毒为VOC/Omicron变异株(BA.1进化分支),与2021年12月北美等地部分毒株相似度较高;而且该病例收发过的国际邮件发现了阳性标本。综合分析,不排除其经境外物品而感染病毒的可能。
3.王仁元任浙江省卫健委主任。1月15日,浙江省十三届人大常委会第三十四次会议经审议表决,决定王仁元任浙江省卫健委主任,免去张平的浙江省卫健委主任职务。根据公开资料,王仁元1966年3月出生,宁波人,此前担任宁波市政府副秘书长,办公厅主任、党组副书记、市政府研究室主任(兼),曾担任宁波市卫生防疫站副站长、宁波市疾控中心主任、宁波市卫生局副局长等职。
评审动态
1. CDE新药受理情况(01月17日)
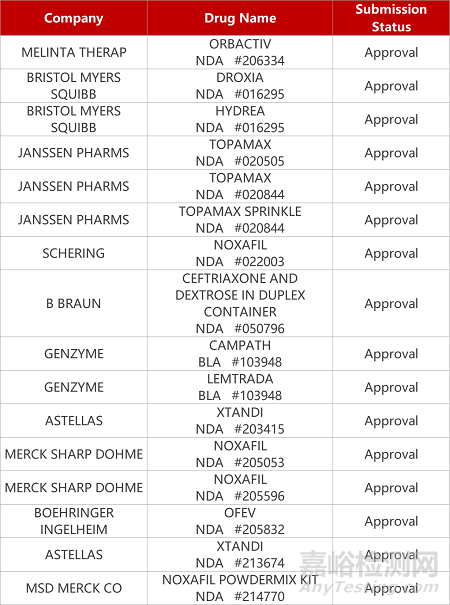
2. FDA新药获批情况(北美01月14日)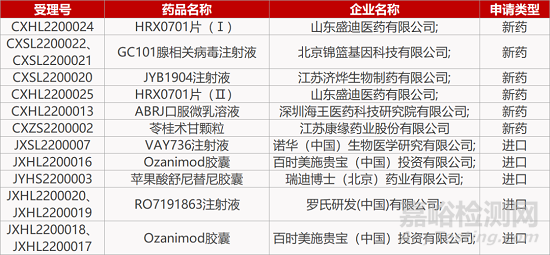

来源:药研发


