您当前的位置:检测资讯 > 监管召回
嘉峪检测网 2022-01-28 21:44
摘 要
每年医疗器械召回总数都有几百甚至上千,本文依据NMPA在2021年的召回数据库来统计,分析得出一些图表和结论来回顾过往的一年医疗器械包装及标识类召回情况。(因2020年统计的数据出了点问题,本文用21年的数据与19年的数据进行对比)。
总体来看,2021年总的召回数量相对于2019年好了很多,下降约33%。看来全球的医疗器械公司在这方面的投入不少,但是仍然还是占据了总召回的比例约15%。除了医疗器械巨头之外,国内公司发布召回的也不少,但是其中有很多是由于国家抽检或者市场反馈才引起的召回。下面就针对2021年全年的数据做一下回顾。由于召回通知书里面部分内容记载较为模糊,也不可能针对每一个案例,还请大家见谅。
本文所有数据来源于国家药品监督管理局召回数据库:http://www.nmpa.gov.cn/WS04/CL2061/
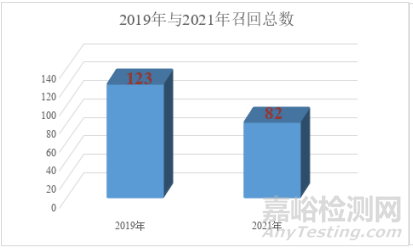
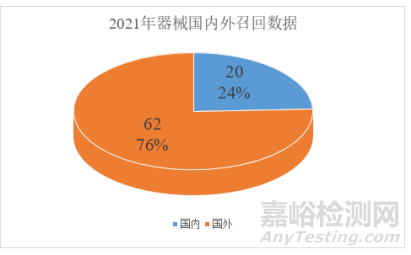
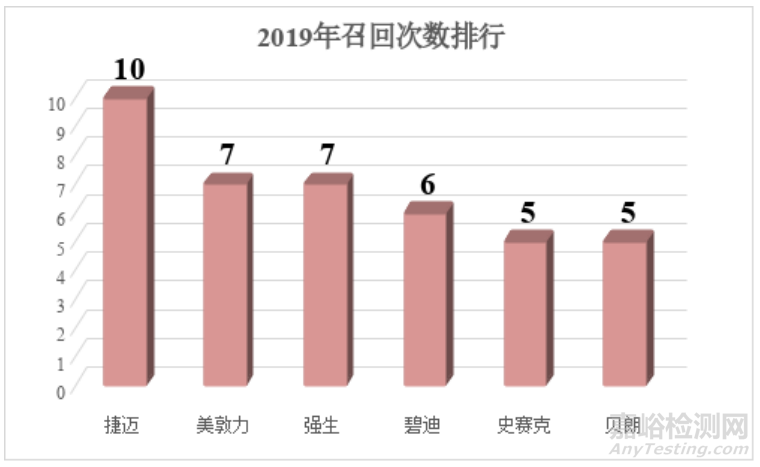
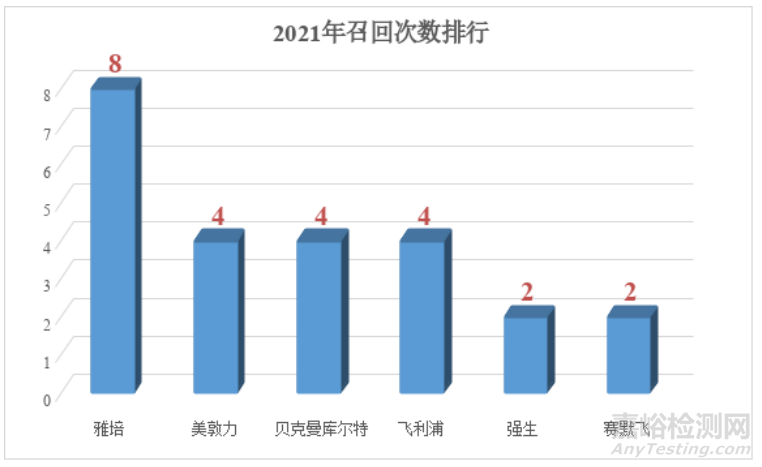
第一幅图统计的关于包装或标识召回总数,2019年有123份,2021年有82份(另有部分召回短时间发生2次的,我也只记录1次;第二幅图是国内企业和外企的召回数量和比例),2021年总共召回次数544次。今年依旧对总召回次数进行排名,对比2019年总数减少了一些,排名企业也发生了较大变化。第一名总数从10次下降到8次。
下面为了方便说明包装或标识哪一类问题,我将总体召回分为5个小类型,分别是:错误生产、不符合标准、信息未更新、包装设计和批次混淆。下面稍微对这几个类型解释一下。
类型解释
错误生产:一般是指包装设计和使用正确的材料的情况下,仅仅是生产过程中出的问题。例如:标签错误印刷,生产日期印刷错误等;
不符合标准:一般情况是指包装不符合法规或者国际指导标准。例如:不符合GB 0670-2008无创自动测量血压计,不符合注册标准的要求等情况;
信息未更新:这种缺陷是指以往的包装或标识的信息是正确的,但是由于注册证换新或者备案资料需要更新时没有及时将最新的信息更新到实际的产品包装或标识上;
包装设计:一般是指在包装设计时没有考虑到一些特殊情况或者没有满足特定的标准,如:某产品说明缺乏必要的信息,无菌包装在使用过程中可能会有细菌侵入可能;
批次混淆:该缺陷是有两种情况,一种是发生在制造过程中,产品未形成成品前与其他产品发生混合;另外一种是在物流运输过程中,大小包装拆分过程中可能发生的混淆。
当然以上的这种分类之间可能存在一些交叉情况,本文仅以这些来大致区分召回的缺陷描述类型,不代表实际的缺陷调查的依据。还请大家不要咬文嚼字,因为各个企业召回的描述也是五花八门,很难通过字面意思了解所有的缺陷实际背景。通过分类发现,这五种类型的数量呈现阶梯式变化。排在前三位的缺陷分别是:1.错误生产2.信息未更新3.不符合标准。这三种缺陷约占整体的77%,所以这三种是我们需要研究的重点内容。
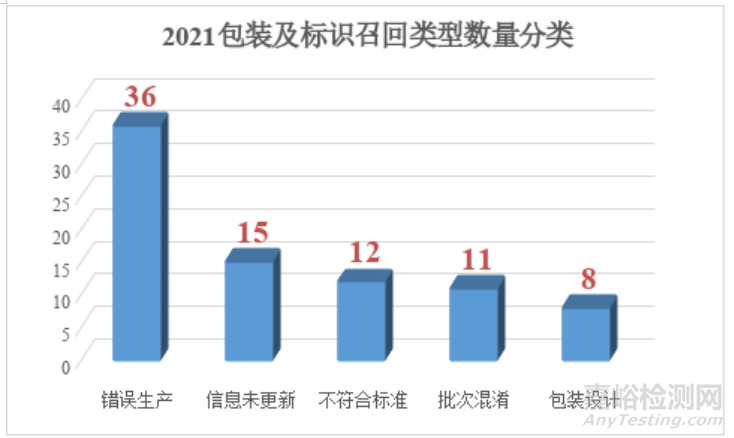
2021年的情况与2019年发生了一些变化,信息未更新的问题从2019年的第三位上升到第二位,主要原因和法规的变化有较大关系。
第一类缺陷是发现最多的,将近44%的缺陷率来自于错误的生产。这也是器械生产过程控制的难点,无论是国际型大企业还是国内的中小企业,在这方面也是难以完全规避。我们来看看主要的召回原因:主要都是标签生产错误和产品与标签不符合。这类问题看起来都是小问题,这些与制造过程的管理直接相关。希望各位同行也引起重视,现场的管理是与产品直接关联的。
第二类是信息未更新,大多数都是注册或备案信息与生产的产品上的信息不一致。这块也呈现了一个特点,主要召回的市场是中国。主要的不合格也是外资企业为主。而且大多数设备是标签和说明书上的注册证信息或产品使用范围发生了变化没有及时更新到最新的产品上导致的。基本上都是因法规变更产品标签和说明书与更新后要求不一致,还有标签和说明书不一致。
第三大缺陷与去年比上升不少,该类问题发生更多见于国外企业,约占该缺陷的91%。根据对这些召回的调查,这类缺陷主要是器械外部标识不符合行业标准。说明书中缺少必要的标识和范围说明。另外一个特点就是对标签的可靠性缺乏确认。
后面的两类问题召回次数较少,说明这类问题已经有较好的流程和规范进行管控。若将批次混淆考虑在生产过程中来说,其实这又增加了第一类的数量。其实很多情况下确实可以这么做。总之,生产过程确实与标签标识召回直接相关的更多,大家在建立流程的时候千万要考虑到各种异常的情况。
结语
写在最后,给大家一个关键性建议,包装的变更在企业内部尤其重要,大部分的问题是由于变更不及时或者没有识别到包装的变更导致召回。建议大家在变更通知单(Change Notice Form)中将包装加入作为一个模块,同时要关注两类情况,一种是产品注册后的信息更新,另外一个是由于市场或者内部成本原因变更的包装结构或设计。

来源:德大器械产业管家


