您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-02-20 08:19
引言
溶出是指活性成分在体外溶出介质中溶出的速度和程度,生物等效性(BE)是指同样试验条件下试验制剂和对照标准制剂在药物的吸收程度和速度的统计学差异,当无统计学差异时即可认为两者等效。
利用药物的体外溶出数据预测其在体内的吸收情况是研发人员的主要工作,但是利用简单的体外溶出条件来预测人体复杂的胃肠道环境是较为困难的,首先需要获得具有区分力的溶出参数,通过参比制剂的溶出数据优化自制制剂的处方、工艺,以提高自制制剂与参比制剂的体外溶出拟合度,科学合理的设计预BE试验,根据预BE试验结果有的放矢的调整制剂的处方、工艺和完善正式BE的试验设计,进而提高正式BE的成功率。
1、寻找溶出的区分力
1.1.处方、工艺是内功
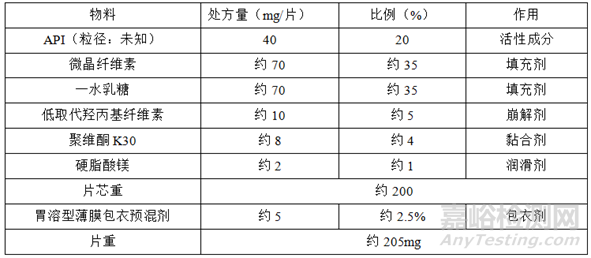
(1)参比制剂处方、工艺解析
根据查询到的公开资料、专利、逆向工程等技术手段确定参比制剂的处方、工艺。
①参比制剂处方
②参比制剂工艺
干混合-湿法制粒-总混-压片(参比制剂平均硬度:66N)-包衣
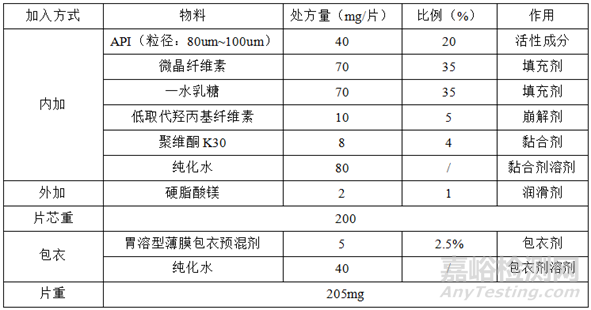
(2)自制制剂处方、工艺
自制制剂和参比制剂处方、工艺高度一致是寻找具有区分力的溶出参数的前提。
处方方面:
两者应处方、用量高度一致,其中包括API的晶型、晶癖、粒度、粒度分布,辅料的型号、理化性质等;
工艺方面:
制粒工艺、粘合剂、崩解剂的加入方式、片剂硬度、包衣厚度等;
制剂不同的处方、工艺可能会崩解出不同大小和均匀性的颗粒,显示出不同的溶出速度和程度。
①自制制剂处方
②自制制剂工艺
1)干混合:将一水乳糖、API、低取代羟丙基纤维素、微晶纤维素过40目筛网后称取处方量,依次加入湿法制粒锅混合均匀(搅拌转速:80r/min,切割转速:1000r/min,混合时间:10min);
2)湿法制粒:搅拌转速:80r/min,切割转速:1000r/min,均匀喷入聚维酮K30溶液,2min内喷液,制粒3min,4目湿整粒,55℃沸腾干燥,干燥失重2~3%,24目干整粒;
3)总混:干整粒后的物料与硬脂酸镁(过40目)1:1手动混合1min,混合均匀(混合转速:25r/min,混合时间:10min);
4)压片:理论片重200mg,重量差异±7.5%(内控±5.0%),目标硬度:65 N (60 N ~70N);
5)包衣:目标增重:2.5%(2.0%~3.0%);
1.2溶出方法是外功
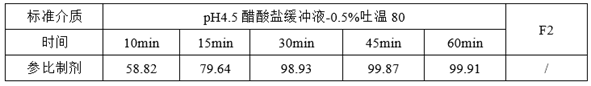
(1)参比制剂的溶出
①参比制剂的溶出方法

②参比制剂的溶出数据
(2)自制制剂的溶出
①自制制剂的溶出方法
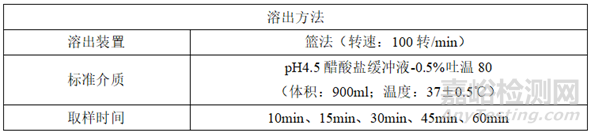
②自制制剂的溶出数据
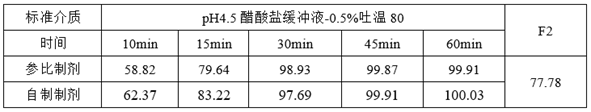
(3)溶出数据分析
①参比制剂和自制制剂溶出速度整体过快
参比制剂和自制制剂溶出速度整体过快,导致溶出数据不能很好的反映出制剂内在的理化性质,造成体外溶出数据拟合度失真(研发人员可能会对溶出数据结果产生误判),需要通过调整溶出方法以降低整体的溶出速度,从而提高自制制剂和参比制剂体外溶出数据的可信度。
降低溶出速度的方法有:
1):降低溶出转速,溶出转速由100转/min降低至75转/min;
2):降低吐温80浓度;
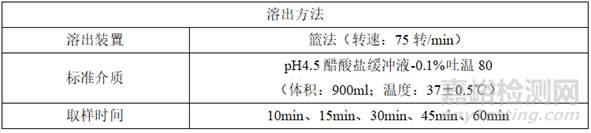
(4)调整后的溶出
①溶出方法
②溶出数据
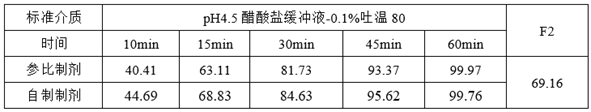
从本品的溶出数据可以看出参比制剂的溶出方法不一定是最优解,因为原研制剂公司为了保护自身利益,提高原研制剂技术壁垒,提交给监管部门的溶出参数可能是经过调整的,属于“阉割版”或“添油加醋版”,因为溶出参数具有不可证伪性,重点去除了溶出参数的区分力。
我们需要重点警惕那些具有高转速、高浓度的表面活性剂、大比例的有机溶剂、过大溶解度介质的溶出参数,以上情况可能造成制剂在不到15分钟的时间内就完全溶出了,这种情况有可能就是原研制剂的‘‘溶出参数烟雾弹’’。
2、海底捞月过BE
(1)优化BE策略
①开发出具有区分力的溶出参数;
②根据参比制剂的溶出数据调整自制制剂处方、工艺,以提高自制制剂与参比制剂的体外溶出拟合度;
③根据参比制剂相关的临床资料,设计出科学合理的预BE试验方案,根据预BE试验数据有的放矢的调整自制制剂的处方、工艺和完善BE试验方案(如优化分析方法、增加试验样本量、调整取样点等措施,以降低临床试验的偶然性风险),进而提高正式BE的成功率;
④加强临床试验合规性管理,提高临床试验质量,降低由于受试者在空腹试验时偷吃食物、瞒药、吐药及不正常脱落等相关风险;
(2)预BE实验
①预BE试验设计
本品为胃溶型薄膜包衣片,根据原研制剂公开的资料显示本品的个体内变异系数>0.3(餐后变异性更大),该制剂为高变异短半衰期品种。根据本品的体内特性,本品预BE试验采用两制剂、两序列、两周期交叉试验设计,餐后12例,采用平均生物等效性(ABE)进行评价。

②预BE试验数据

③预BE试验结果
预BE试验结果判断:自制制剂和参比制剂具有生物等效性。
(3)正式BE实验
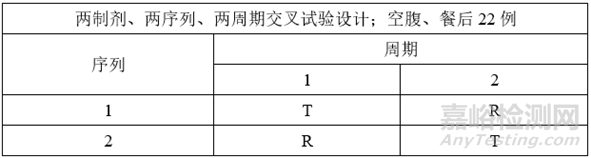
①正式BE试验设计
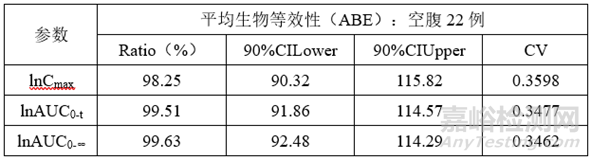
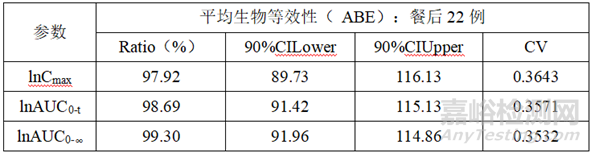
根据预BE试验设计方案及结果,本品正式BE试验采用两制剂、两序列、两周期交叉试验设计,空腹、餐后22例,采用平均生物等效性(ABE)进行评价。
②正式BE试验数据
1)空腹试验数据
2)餐后试验数据
③正式BE试验结果
正式BE试验结果判断:自制制剂和参比制剂具有生物等效性。
3、总结
审慎的使用公开的溶出数据,始终带着科学、怀疑的眼光看待公开的溶出数据是寻找具有区分力溶出参数的基础,要做到“不撞南墙就回头”,尽可能的保证自制制剂和参比制剂处方、工艺的一致性,再通过具有区分力的溶出数据不断优化自制制剂的处方、工艺,系统的分析药物制剂的理化性质和胃肠道系统的生理状态,将体外溶出与体内释放、吸收结合起来,科学合理的设计BE试验,充分保证BE试验质量,从而提高BE的成功率。
4、参考文献
1. 国家食品药品监督管理总局《普通口服固体制剂溶出度试验技术指导原则》(2015 年 2 月).
2. 国家食品药品监督管理总局《已上市化学药品药学变更研究技术指导原则(试行)》溶出曲线研究的问答》(2022 年11 月).
3.国家食品药品监督管理总局《普通口服固体制剂溶出曲线测定与比较指导原则》(2016 年 3 月).
4.《中国药典2020版四部(0931 溶出度与释放度测定法)》.
5.国家食品药品监督管理总局《人体生物等效性试验豁免指导原则》(2016 年 5 月).
6. Amidon, G. L., H. Lennernas, V. P. Shah, and J. R. Crison, 1995, “A Theoretical Basis For a Biopharmaceutic Drug Classification: The Correlation of In Vitro Drug ProductDissolution and In Vivo Bioavailability,” Pharmaceutical Research, 2:413-420.
7. Moore, J. W. and H. H. Flanner, 1996,“Mathematical Comparison of Dissolution Profiles,”Pharmaceutical Technology, 20 (6):64-74.

来源:药事纵横


