您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-02-16 10:26
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
1.GSK贝利尤单抗在华获批新适应症。葛兰素史克贝利尤单抗Benlysta(倍力腾)获国家药监局批准新适应症,用于治疗正在接受标准护理的活动性狼疮性肾炎(LN)成人患者。此前,Benlysta已获批作为附加疗法,用于治疗5岁及以上活动性系统性红斑狼疮(SLE)儿童和成人患者。此次获批,使Benlysta成为中国首个也是唯一一个被批准同时用于治疗SLE和LN的生物制剂。
2.首款CD19-ADC疗法启动国际Ⅲ期临床。ADC Therapeutics SA公司靶向CD19的抗体偶联药物(ADC)loncastuximab tesirine在中国登记启动国际多中心Ⅲ期临床,评估Loncastuximab Tesirine联合利妥昔单抗治疗与标准免疫化疗相比用于复发或难治性弥漫大B细胞淋巴瘤(DLBCL)的疗效。该试验主要研究者将由中国医学科学院血液病医院邱录贵博士,试验目标入组人数为中国大陆60人,国际入组350人。该新药是首款获得FDA批准靶向CD19的抗体偶联药物。
3.正大天晴PD-1/TGFβ双抗启动临床。正大天晴1类新药TQB2868注射液登记启动一项I期临床试验,评估用于晚期恶性肿瘤受试者中的安全性和耐受性,药代动力学特征以及初步抗肿瘤疗效等。TQB2868是一款PD-1/TGFβ双特异性融合蛋白。此前,国内同靶点新药君实生物的JS201注射液和维立志博的注射用LBL-015已启动了临床试验。该项I期临床主要研究者将由上海市肺科医院周彩存医学博士担任。
4.徐诺RAF抑制剂将报IND。徐诺药业日前完成与FDA的pre-IND会议,并计划今年第1季度向FDA递交广谱RAF抑制剂XP-102的全球多中心Ⅰ/Ⅱa期临床试验申请,用于结直肠癌、非小细胞肺癌、恶性黑色素瘤和甲状腺肿瘤。该公司同时还会向FDA申请XP-102治疗结直肠癌和恶性黑色素瘤的快速通道资格。XP-102是由徐诺药业以总价值约5亿美元从勃林格殷格翰引进,徐诺药业拥有XP-102全球权益。
5.药捷安康新型BTK抑制剂报IND。药捷安康1类新药TT-01488片的临床试验申请获CDE受理。TT-01488是一款新型非共价的可逆BTK抑制剂,有望克服由共价BTK抑制剂引发的获得性耐药,拟开发用于多种复发性或难治性血液恶性肿瘤的治疗。药捷安康计划在中美同步递交临床试验申请,并在获批后在全球范围内启动血液恶性肿瘤的临床试验。
6.药明康德发布2021业绩快报。2月15日,药明康德公布2021年业绩报告。2021年公司实现营收2,290,238.51万元,同比增长38.50%,实现归母净利润509,715.53万元,同比增长72.19%。2021年各业务板块收入:化学业务1,408,722.02万元(+46.93%);测试业务452,511.13万元(+38.03%);生物学业务198,509.25万元(+30.05%);细胞及基因疗法CTDMO业务102,640.12万元(-2.79%);国内新药研发部125,103.99万元(+17.47%)。
国际药讯
1.急性偏头痛药物Ⅲ期亚太地区数据积极。Biohaven公司和辉瑞联合开发的口服CGRP受体拮抗剂rimegepant治疗急性偏头痛的亚太地区Ⅲ期临床达到共同主要终点。单次口服75 mg rimegepant在2小时内显著缓解偏头痛症状并让患者恢复正常功能。并且,该药可提供长达48小时的持续疗效。rimegepant的安全性特征与美国的临床研究一致。目前,rimegepant(Nurtec)已获FDA批准用于急性治疗偏头痛发作,和预防性治疗偏头痛。
2.庞贝病疗法Nexviazyme长期疗效积极。赛诺菲(Sanofi)M6P靶向酶替代疗法Nexviazyme(avalglucosidase alfa,neoGAA)治疗晚发型庞贝病(LOPD)患者的关键Ⅲ期COMET试验(NCT02782741)新数据积极。在双盲期和扩展期(近2年)均接受Nexviazyme治疗的患者,预测的FVC(用力肺活量)百分比较基线提高2.65分(SE=1.05),6分钟步行距离较基线增加18.6米(SE=12.01),而仅在扩展期内接受Nexviazyme治疗的患者的上述数据分别为0.36分(SE=1.12)和4.56米(SE=12.44)。2021年8月,FDA已批准Nexviazyme用于治疗LOPD。
3.新型RSV疫苗获突破性疗法认定。Bavarian Nordic公司基于5种抗原设计的候选疫苗MVA-BN RSV获FDA授予突破性疗法认定,用于60岁或以上成人的主动免疫,以预防呼吸道合胞病毒(RSV)引起的下呼吸道疾病。MVA-BN RSV在18-50岁健康成人中预防症状性RSV感染有效率达到79%。而且在老年受试者中该疫苗耐受性良好,可诱导广泛和持久的抗RSV抗体和T细胞应答。Bavarian Nordic计划于2022年启动MVA-BN RSV的Ⅲ期临床试验。
4.多靶点NASH创新药获快速通道资格。FDA授予Axcella Therapeutics公司基于内源性代谢调节剂(EMM)组合开发的多靶点口服药物AXA1125快速通道资格,用于治疗伴肝纤维化非酒精性脂肪性肝炎(NASH)。该公司的EMM组合旨在通过同时作用于多个代谢通路,产生协同效应,从而治疗复杂疾病。AXA1125目前正在一项针对NASH患者的Ⅱb期临床试验中接受评估,预计在今年获得中期结果。
5.雄激素受体PROTAC早期临床积极。Arvinas公司AR靶向PROTAC蛋白降解剂bavdegalutamide(ARV-110)治疗转移性去势抵抗性前列腺癌的临床数据积极。bavdegalutamide在携带AR T878X/H875Y突变肿瘤患者中的PSA50率(前列腺特异性抗原PSA水平降低≥50%)达到46%(n=26);其中7例可评估患者中,有2例获得确认的部分缓解。bavdegalutamide(420 mg)耐受性可控。该公司计划在今年年底前启动关键性临床试验。
6.安斯泰来庞贝病基因疗法早期临床积极。安斯泰来AAV基因替代疗法AT845治疗晚发型庞贝病(PD)的Ⅰ/Ⅱ期FORTIS试验中期数据积极。4例患者分2个队列分别接受一次性外周静脉输注AT845(队列1:剂量为3×10E13 vg/kg;队列2:剂量为6×10E13 vg/kg)。随访24周期间,AT845的安全性和耐受性良好,没有发生严重不良事件。PD是一种罕见的常染色体隐性遗传代谢疾病,以进行性肌肉退行性变为特征,由GAA基因突变引起。
医药热点
1.2021年全球药企TOP10出炉。随着各跨国药企2021年年报的陆续披露 ,全球TOP10药企排名也相应出炉。按总营收排序,TOP10依次是强生(938亿美元,+13.6%)、辉瑞(812.88亿美元,+95%)、罗氏(约678亿美元,+9.3%)、艾伯维(562亿美元,+22.7%)、诺华(516亿美元,+6%)、默沙东(487亿美元,+17%)、百世美施贵宝(464亿美元,+9%)、葛兰素史克(469亿美元,+7%)、赛诺菲(约432亿美元,+7.1 %)、阿斯利康(374亿美元,+41%)。
2.国家卫健委内设机构大调整。根据国务院日前发布《关于调整国家卫生健康委员会职能配置、内设机构和人员编制的通知》,国家卫健委内设机构将作出以下重大调整:医政医管局更名为医政司;卫生应急办公室(公共卫生事件应急指挥中心)更名为医疗应急司;撤销国家卫健委疾病预防控制局、综合监督局。调整后,国家卫健委设19个内设机构及机关党委(党组巡视工作领导小组办公室)、离退休干部局机关行政编制464名。
评审动态

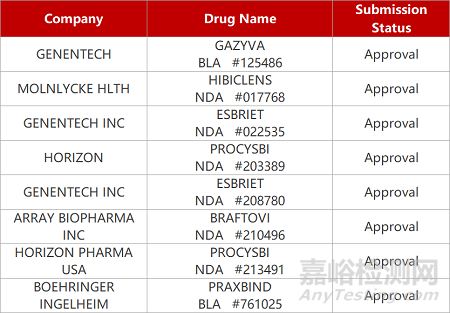

来源:药研发


