您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-07-14 11:20
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
1.先声CDK4/6抑制剂国内获批上市。先声药业从G1 Therapeutics引进的CDK4/6抑制剂注射用曲拉西利(Trilaciclib)获国家药监局批准上市,用于降低广泛期小细胞肺癌患者化疗引起的骨髓抑制频率。Trilaciclib(Cosela)早在2021年2月获FDA批准上市,是全球首个且唯一具有全面骨髓保护的药物。除小细胞肺癌外,Trilaciclib也获得CDE临床许可,在Ⅲ期临床中评估用于转移性结直肠癌和三阴乳腺癌的骨髓保护。
2.华东医药利拉鲁肽报产用于减肥。NMPA受理华东医药旗下中美华东申报的利拉鲁肽注射液用于肥胖或超重适应症的上市许可申请。这是一款GLP-1受体激动剂,原研产品由诺和诺德研发,目前已获批用于糖尿病(商品名Victoza)和减肥(商品名为Saxenda)等适应症。2011年,原研产品获批以诺和力为商品名进入中国市场。目前,国内还有3家企业正在进行利拉鲁肽注射液肥胖或超重适应症的临床试验。
3.礼来度拉糖肽降糖III期临床成功。礼来GLP-1受体激动剂度拉糖肽(度易达®)联合甘精胰岛素(伴二甲双胍治疗和/或阿卡波糖)在治疗2型糖尿病的中国III期临床AWARD-CHN3达到主要终点和所有关键次要终点。与安慰剂联合胰岛素相比,这一组合28周治疗后显著降低患者的糖化血红蛋白(HbA1c)、体重及空腹血清葡萄糖。药物安全性特征与既往研究一致。
4.罗氏C5补体抑制剂拟纳入优先审评。罗氏C5单抗crovalimab注射液(RO7112689)获CDE拟纳入优先审评,用于治疗阵发性睡眠性血红蛋白尿症(PNH)患者。在一项III期临床(COMMODORE 3)中,结果显示,以乳酸脱氢酶水平测定的溶血控制的平均比例、以及避免输血(TA)的患者比例均达到共同主要终点。此前,CDE已将crovalimab纳入突破性治疗品种,用于体重≥40kg、目前未接受补体抑制剂治疗的PNH患者。
5.信达PD-1/IL2抗体国内启动临床。信达生物PD-1/IL2抗体融合蛋白IBI363首次在国内登记启动一项Ia/Ib期临床,拟评估用于治疗晚期实体瘤或淋巴瘤受试者的安全性、耐受性和药代动力学(PK)特征,以及初步抗肿瘤活性。主要研究者由浙江大学医学院附属第一医院主任医师梁廷波和白雪莉共同担任。据悉,该新药目前正在澳大利亚开展Ⅰ期临床,针对晚期恶性实体瘤和淋巴瘤受试者。
6.君实CD20/CD3双抗获批临床。君实生物自主研发的1类生物药注射用JS203获国家药监局临床试验默示许可,拟用于复发难治B细胞非霍奇金淋巴瘤的治疗。JS203是一款重组人源化抗CD20和CD3双抗,通过联结并活化T细胞(结合CD3)和淋巴瘤细胞(结合CD20),可有效促进T细胞杀伤淋巴瘤细胞。国内包括爱思迈,正大天晴,康诺亚/诺诚健华等药企也在布局同类药品,大多数处于Ⅰ期临床阶段。
国际药讯
1.FIC干眼症新药将在美报NDA。Aldeyra公司潜在“first-in-class”的小分子活性醛化物质(RASP)抑制剂reproxalap,在治疗干眼症患者的临床试验中达到主要与次要终点。接受一天reproxalap(0.25%)治疗后,患者在干燥眼房(dry eye chamber)中的眼睛发红情形(P=0.0004)与Schirmer测试(P=0.0005)上均显著优于载体对照组。值得一提的是,这款眼药水可10分钟内快速缓解干眼症状。该公司计划今年第3季度向FDA递交NDA。
2.MPS IIIA基因疗法Ⅱ/Ⅲ期临床积极。Lysogene公司基因疗法LYS-SAF302治疗黏多糖贮积症IIIA型(MPS IIIA)的Ⅱ/Ⅲ期临床结果积极。接受LYS-SAF302治疗24个月后,患者的脑脊液HS(疾病生物标志物)水平(1654±497 ng/ml,平均值±SD,n=15)较基线(2159±589 ng/ml,平均值±SD,n=16)显著降低22%(P=0.015)。研究中未观察到对血清HS水平影响的统计学显著性。此外,患者的BSID-III语言和运动发育评分稳定或持续增加。
3.诺和诺德血友病双抗早期临床积极。诺和诺德双特异性抗体Mim8在ISTH2022大会上公布用于治疗血友病A的Ⅰ/Ⅱ期临床FRONTIER1积极结果。每周一次不同剂量(1、3、9、20 µg/ml)或是每月一次(9 µg/ml)皮下注射药物,患者(无论体内是否含有FVIII抑制物)的总体耐受性良好,其中,接受每月一次频率治疗的8例患者中没有出血情形产生。临床中没有血栓栓塞或相关严重不良反应。
4.MacroGenics终止B7-H3单抗Ⅱ期研究。MacroGenics公司宣布终止B7-H3单抗enoblituzumab与PD-1单抗retifanlimab或tebotelimab联合一线治疗复发性或转移性头颈部鳞状细胞癌(SCCHN)的Ⅱ期研究(CP-MGA271-06)。因为该项试验的两个组别中共发生7起可能与出血事件有关的死亡事件(n=62)。其中6例死亡被评估为与研究治疗无关,1例死亡被认为可能与治疗有关。2019年7月,天境生物与MacroGenics公司达成合作,获得enoblituzumab在中国大陆、香港、澳门及台湾的独家授权。
5.Spectral创新器械获FDA突破性器械认定。FDA授予Spectral Medical公司治疗性血流灌注设备Toraymyxin(PMX)突破性医疗器械认定,用于治疗内毒素感染导致的脓毒性休克。在评估使用PMX进行多黏菌素B血液灌注治疗内毒素血症和感染性休克成人患者的关键临床EUPHRATES中,当PMX应用于内毒素活性基线值介于0.6和0.9之间的脓毒性休克患者时,可降低患者死亡率并改善器官功能障碍。
6.抗病毒药物公司Apriori Bio获资本助力。Apriori Bio公司宣布获得Flagship Pioneering公司的5000万美元投资资金。Apriori开发了一套独特生物导向的人工智能系统Octavia。通过对现有病毒变异演化路径的学习,Octavia可根据锚定序列(anchor sequences)在体外生产数百万合成的变异序列,并测量抗体和细胞受体与每个变种结合的能力。它还可以建立模型以预测每一个变异在真实世界中的变化,并针对性开发相应的抗体和疫苗。
医药热点
1.第七批国家集采拟中选药品公布。7月13日,上海阳光医药采购网公示第七批国家组织药品集中带量采购拟中选结果,295家企业的488个产品参与投标,217家企业的327个产品获得拟中选资格。其中,6家跨国药企的6个产品中选,211家国内药企的321个产品中选,投标企业中选比例达73%,拟中选药品平均降价48%,预计每年可节省费用185亿元。
2.广安门医院济南医院启动建设。7月12日,中国中医科学院广安门医院济南医院项目在山东省济南市正式启动。该项目在济南国际医学科学中心医疗硅谷核心区,建设占地4.83公顷、总建筑面积24万平方米、总投资31亿元,医院床位规模约1000张,预计2024年完工。据悉,该院建成后,将通过建设临床诊疗中心、人才培养中心和科研创新转化平台,开展疑难危重症诊疗技术攻关、前沿医学科研创新转化和高水平国际合作,确保实现国家区域医疗中心职能要求。
3.我国鼓励地方开展HPV疫苗免费接种。国家卫健委就十三届全国人大五次会议针对HPV疫苗接种的相关建议做出回复。国家卫健委将大力推广广东、海南、福建等省份经验,总结各地利用政府民生项目和医保基金等多渠道筹资的经验做法,鼓励地方先行先试,重点推动条件成熟的地区率先出台免费HPV疫苗接种政策,不断提高适龄女孩HPV疫苗接种率。
评审动态
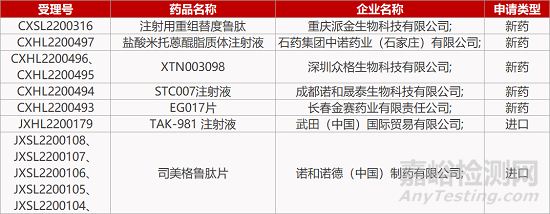
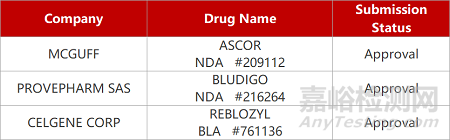
1. CDE新药受理情况(07月12日)

来源:药研发


