您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-08-23 11:27
导语
据《中国心血管健康与疾病报告2020》显示,我国约有心血管疾病患者3.3亿人,并呈逐年递增趋势,已成为重大公共卫生问题,给社会造成了巨大的经济负担和压力。然而,用于血管替换、旁路建立或为终末期肾脏患者建立血透通路的人工血管的研发仍然面临诸多困难与挑战。
由于材料、技术受限,小口径人工血管(口径<6 mm)一直是研发重点难点,目前仍无上市产品。
01小口径人工血管有哪些制造要点?
小口径人工血管在临床上表现不佳,主要是由于内膜增生和血栓形成的发展。为了克服这些挑战,已采用各种设计方法、材料选择和表面改性策略来提高小直径移植物的通畅性。包括材料选择、表面改性以增强生物相容性/内皮化,以及目前正在植入的移植物的机械性能。
理想的小口径移植物应具有如下特点:
良好的机械强度和顺应性以承受血流动力学压力;
可缝合性;
紧急情况下各种尺寸的“现成”可用性;
易于使用,可最大限度地减少手术时间、成本和风险;抗血栓和抗感染;
生物相容性,可与身体完全融合,并产生在性质和功能上与天然动脉相似的新血管;
合理的制造成本;
长期通畅;
快速内皮化;
良好的孔隙率>50 μm,便于细胞浸润。
满足上述所有要求的功能性小口径血管移植物需要仿生设计,需要对血管壁生物学的细胞和分子的高度理解。
(一)孔隙率的重要性:
快速内皮化是小直径血管成功预防血栓形成的一个重要方面。在这个过程中,孔隙率和孔径分布起着重要作用。在过去的五年里,无数的研究表明了孔隙率在移植物设计中的重要性。
最近的研究结果表明,人工血管的多孔管腔表面在稳定内膜和帮助细胞浸润方面发挥重要作用:多孔管腔表面增强了移植物周围组织的渗透,起到锚固作用。然而,多孔人工血管内部压力,往往会随着时间的推移失去其径向机械强度,可能导致动脉瘤形成。消除这一障碍的方法之一,是对移植物施加外部加固。
过去二十年内,有研究分别使用涤纶管状针织网、纬编管状织物、涤纶氨纶织物、聚酯等材料来增强小直径血管移植物。使用聚酯增强材料在犬腹主动脉模型中尽管有血栓的形成,但是明显观测到,具有丝状、多孔、互连结构和外部增强聚酯网的血管移植物,优于具有低孔隙率或不可穿透壁的血管移植物。这也进一步说明孔隙率在人工血管的设计中至关重要。
(二)表面生物活性材料的应用:
可生物降解支架的另一个重要特性是降解应与模拟正常组织中 ECM 功能的组织再生相平衡。考虑到不同材料与细胞相互作用的方式可能会引发各种反应,表面生物活性材料(细胞刺激信号)可以改变细胞反应以促进正生长。因此,这些品质可以调节细胞功能和行为,还可以促进组织生长。
02人工血管现有制造工艺及方法汇总
迄今为止,人工血管采用的大多数制造方法有如下几种:
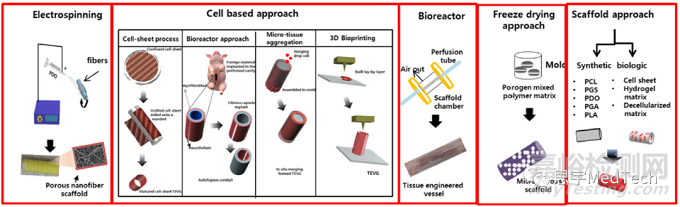
(从左到右)静电纺丝、基于细胞的完全生物法、生物反应器、冻干法、支架法
静电纺丝是组织工程师用于制造可降解支架的通用方法之一,因为它与许多聚合物兼容,并且可定制,足以制造具有优化性能的血管导管。该过程在应用电场中将溶解在挥发性溶剂中的聚合物转化为纳米和微纤维。然而,为了创建诸如血管的管状结构,通常使用具有与目标血管相匹配的直径的快速旋转心轴。通过控制电压、流速、聚合物浓度、喷嘴尺寸、距离、转速和溶剂等各种参数,可以改变所得支架的厚度、密度和物理特性。
冷冻干燥或冻干是另一种使用升华原理去除聚合物溶液中存在的溶剂的方法。在这种方法中,将聚合物溶液倒入模具中并转移到冷冻干燥器中,让溶剂在其中升华。可以通过改变冷冻速率和溶质浓度来优化构建体的孔径。
致孔剂或颗粒浸出是另一种方法,其中致孔剂(糖、盐、蜡)或颗粒用于在通过蒸发浸出之前产生孔隙。
其他一些用于生成血管构造的方法包括溶剂浇注、发泡、相分离、纤维粘合、自组装、快速成型、熔体成型和膜层压。生物反应器用于组织工程,将细胞和基于组织的结构转化为临床有效且安全的大型生物产品。一项研究使用生物反应器将人类诱导的多能干细胞接种到 PGA 支架上长达 9 周,从而产生由对 α-平滑肌肌动蛋白呈阳性的细胞组成的血管。
03小口径人工血管材料——特殊性能 & 最新研究结果
(一) 人工合成材料
用于外周血管重建的最常见的市售不可降解合成移植物是 e-PTFE (Teflon) 和 PET(涤纶)。这些生物稳定的移植物主要用于临床,因为它们具有出色的抗降解性、良好的机械强度以及在较大直径应用中的可负担性。
1. 膨体聚四氟乙烯e-PTFE (Teflon)
PTFE 是一种碳氟聚合物,通常通过挤压和烧结进行结构转变以形成 ePTFE(Gore-Tex),从而在其基体中引入周向排列的节点的微孔结构。该材料具有负电性腔表面,具有抗血栓形成特性,适用于下肢旁路移植术(7-9 mm)。大多数外科医生更喜欢不透水和浸渍的针织 e-PTFE 移植物,以避免需要预先凝血。由于其刚性,该移植物对天然血管的顺应性差导致表面非内皮化,从而导致手术后的通畅性差。近年来,对e-PTFE研究工作集中在该产品的表面改性和外部增强上,以减轻小直径移植物的这些挑战。
2. 涤纶Dacron (PET)
PET 是一种具有多根长丝的聚酯材料,通常被针织或编织成人工血管,可以用作 ePTFE 的替代品;然而,它们在长期体内小直径血管中的通畅性差仍然限制了它们在临床上的使用。
几项研究表明,针织涤纶随着时间的推移会发生扩张,需要用明胶、胶原蛋白或白蛋白进行预凝固以封闭空隙,并防止手术后出汗或血浆渗漏。
PET的另一个限制是表面疏水性,它阻碍了内皮细胞的粘附和增殖,从而导致血小板活化和血栓形成。根据最近的一项研究,等离子体表面处理被用于用大气气体对涤纶表面进行功能化,从而使其更具亲水性。研究结果表明,细胞相互作用得到增强,而没有不良的炎症组织反应。另一种选择是抗血栓形成分子的表面固定,例如肝素或增强更快内皮化的生物活性蛋白。最近,许多研究人员使用静电纺丝将涤纶与亲水性聚合物(如明胶)结合起来,以提高其生物相容性。
3. 聚氨酯 (PU)
PU在 1960 年代作为血管移植物被引入,以应对诸如在当时使用的血管中观察到的顺应性不匹配导致的内膜增生等挑战。这种移植物优于 e-PTFE 是由于更好的顺应性和接近天然血管的机械性能。聚氨酯通常由软无定形和硬结晶段组成,它们通过氢键和范德华力结合在一起,从而具有固有的刚度和柔韧性。与 e-PTFE 相比,PU 移植物的低血栓形成表面在用针刺穿后可以立即自我愈合,从而导致吻合后的血浆泄漏最小。通过控制硬段和软段的浓度,可以优化顺应性以抑制内膜增生。
尽管它们的机械顺应性有所提高,但由于生物稳定性差和自主降解,早期的体内试验失败了。在植入后 8 周,两类 PU——聚酯和聚醚分别通过水解和氧化降解并释放有毒副产物。用于膝下血管置换的小直径 PU 移植物(内径 5 和 6 毫米)在第一年后因多例血栓形成而退出市场,其中 15 个移植物中有 8 个被阻塞,几乎没有内皮细胞的覆盖。
为了提高 PU的生物稳定性,一项特殊的研究用硅氧烷或碳酸酯代替了大分子二醇,从而产生了具有聚碳酸酯软链段的新接枝物,显示出增强的抗生物降解性,因此可以保留在该部位很长一段时间。在 1.5 mm 聚碳酸酯和 e-PFTE 的比较体内研究中,观察到植入大鼠主动脉的移植物可稳定长达 6 个月。研究结果表明,聚碳酸酯移植物在更快的内皮化和抑制内膜增生方面优于 ePTFE;然而,通畅性没有明显差异(~80%)。
虽然 PU 移植物的一些结果看起来很有希望,但需要探索一种表面改性的替代方法,以了解这种材料的适用性。
(二) 生物可降解、吸收的聚合物
由于在体内生物稳定材料上观察到诸如晚期内膜增生等并发症,研究人员最近开始集中精力开发支架形式的可生物降解和可生物吸收材料。这些材料通常充当 ECM 细胞浸润和沉积的支持物和基质,它们最终会溶解,留下功能性组织,从而最大限度地减少长期后果。
静电纺丝是在这些聚合物上采用的一种策略,用于制造由适合细胞浸润、分化和新毛细血管形成的微米级和纳米级纤维组成的管状多孔移植物。这些移植物的体内代谢,植入后减少了通常导致移植物失败的不良组织相互作用的可能性。
1. 聚甘油-癸二酸酯 (PGS)
这种弹性体材料于 2002 年首次合成,其柔韧性、生物相容性和生物降解性等特性吸引了众多研究人员。甘油和癸二酸单体的缩聚反应是合成这种材料的主要工艺,这种材料独特的弹性特性是共价交联加上主链上羟基之间的多个氢键的结果。这种材料可以生物降解并通过正常途径在体内重新吸收。
尽管对这种材料的体外和体内研究仍处于初步阶段,但迄今为止的结果很令人振奋。在之前的一项研究中,PGS 被证实在大鼠皮下植入约 60 天后可生物降解,植入物周围不会留下疤痕组织。用 PGS 构建的血管支架具有分别为 75 至 150 和 5 至 20 μm 的大孔和微孔,可促进良好的细胞活性,促进内皮细胞的增殖和血管重塑过程中平滑肌细胞的浸润。与 e-PTFE 和 PLGA 相比,在 PGS 上观察到血小板和炎症潜能降低。大鼠模型中PGS 支架可增强弹性蛋白的表达,在植入后 3 周内将机械性能提高五倍,以匹配天然血管的机械性能。由 PGS 组成的复合移植物的未来设计和制造有较好的前景。
2. 聚乙醇酸 (PGA) 和 聚乳酸 (PLA) 聚合物
PGA 和 PLA 聚合物具有生物可吸收性,由饱和聚-ἀ-羟基酯组成,结合后形成 PLGA 的无定形复合材料。PLA 上的额外甲基使其比PGA 更具疏水性,降解速度更快。这些聚合物通过其主链上的酯键水解而降解,导致形成乙醇酸和乳酸单体,这些单体可以正常代谢。
最近一项关于 PGA、PLA 和 PLGA 纳米纤维在血管应用中的体内研究,由于 2 个月内的快速吸收而面临挑战。而另一项研究中,由 PLA 和 PGA 制成的复合移植物由于无法承受动脉压力的快速聚合物降解而显示出机械强度的损失和动脉瘤的形成。对此材料在血管上的应用,还需要更多的表面增强,或多种材料的应用,以弥补自身性能的不足。
3. 聚二恶烷酮 (PDO)
PDO 是一种无色、结晶、可生物降解的合成聚合物。化学结构包含一个多重重复的醚酯单元。这种聚合物可以很容易地挤出成柔性纤维。PDO 先前已应用于针、缝合夹和整形手术材料,以及药物输送系统、心血管设备和组织工程,这些材料会缓慢降解并被人体吸收,而其余部分则通过尿液排出并呼出作为二氧化碳。
最近在血管移植物设计中应用 PDO 已显示出良好的管腔内皮化。对移植后的PDO进行的爆破压力测试可承受高达 6000 mmHg 的压力而不会产生疲劳。多项研究检查了 PDO 支架在血管和非血管器官(如食道、气管和肠道)中的使用。与其他聚酯相比,PDO 最具优势的特性是与天然血管 细胞外基质(ECM)的机械相似性——特别是胶原蛋白和弹性蛋白。这与其形状记忆行为相结合,可提供回弹和抗扭结性。PDO是一种很具有优势与前景的人工血管材料。
4. 聚 ε-己内酯 (PCL)
PCL 是一种生物相容性和生物可吸收性聚合物,由于其良好的机械性能和简单的合成步骤,PCL可应用于许多生物医学领域。在生理环境中植入 PCL 后,发生非酶水解,释放出大量无毒副产物。接下来,包括巨噬细胞和吞噬体在内的周围细胞通过细胞内生理生化过程降解副产物。研究观察到 PCL材料的其机械性能随着降解时间发生变化(更硬),这是由于与其他可生物降解聚合物相比,由于无定形比例降低和结晶度提高导致在体内的存在时间更长(长达 2 年)。因此,这为细胞浸润和组织再生提供了足够的时间。此外,FDA 对 PCL 和其他 PCL 产品的批准使许多研究人员专注于用这种材料构建可行的血管移植物。
PCL 移植物通常使用静电纺丝方法制造,模仿了弹性细胞外基质ECM的结构,克服由于动态血管组织中的循环应力导致的塑性变形。电纺 PCL 的形态(孔隙率和纤维直径)可以通过改变纺丝参数(如聚合物浓度和使用的溶剂)来调整。大鼠主动脉中 2 毫米、PCL 和 e-PTFE 移植物的体内检查显示,在 12 周时 PCL 成功内皮化,通畅性优于 ePTFE。长达 18 个月的长期观察显示出类似的趋势,内皮化稳定,PCL 移植物没有动脉瘤扩张或血栓形成。
长达 12 个月的观察显示,自体动脉外膜层进行性细胞浸润,这是由分泌血管生成因子的巨噬细胞诱导的,从而使肌成纤维细胞能够形成毛细血管和移植物定植。然而,12 个月后,观察到退化的组织重塑,因为较少的巨噬细胞导致细胞流入减少,导致 18 个月时肌成纤维细胞饥饿和移植物钙化。在 6 个月时对基于胶原蛋白、PLA 和 PGA 的移植物的长期研究中进行了类似的观察。因此,使用这些材料的新血管移植物设计需要进一步的长期研究。
(三) 天然高分子材料
天然高分子材料是可以用作组织再生支架的天然蛋白质,它们具有高度的生物相容性和可降解性,从而促进细胞生长。更重要的是,它们与细胞相互作用和结合并增强细胞活性的能力使其优于合成聚合物。迄今为止,用于血管移植物发育的一些天然蛋白质存在于细胞外基质ECM中,分别是胶原蛋白和弹性蛋白,还有其他与生物相容的化合物,如丝素蛋白。在血管移植物制造中使用天然聚合物的挑战之一是它们固有的弱机械性能,由于血管壁上的持续脉动应力可能会失效,导致动脉瘤和血管破裂。
1. 弹性蛋白 (Elastin)
弹性蛋白是天然血管的重要组成成分之一,动脉壁内部和外部弹性薄片层的大约 50% 干重由弹性蛋白组成。弹性蛋白是通过多级过程聚合原弹性蛋白单体而合成的。弹性蛋白促进其在人工移植血管中的识别的两个重要特性是其出色的弹性和信号传导能力。有研究发现由胶原蛋白制成并与弹性蛋白结合的移植基质具有良好的弹性回缩力,因此可以承受脉动流动期间的压力。此外,观察到弹性蛋白负责调节平滑肌细胞的迁移和增殖,抑制内膜增生的形成。
弹性蛋白与其他合成可生物降解聚合物 (如PC和PLGA) 的共静电纺丝,表现出非血栓形成的独特优势;与PDO混合材料人工血管表现出与天然血管相匹配的增强爆裂压力。弹性蛋白可以增强小口径人工血管的机械和生物学特性,弹性蛋白的引入是构建小口径人工血管的新方向之一。
2. 胶原蛋白
胶原蛋白由天然血管的中膜和外膜中的平滑肌细胞和成纤维细胞合成,这也是血管细胞外基质ECM的主要成分之一。胶原蛋白通过维持它们的结构完整性并限制它们的伸长来充当这些细胞的稳定剂。然而,由于胶原蛋白固有的血栓形成性,可引发血小板粘附和活化,是人工血管研发过程中一个严峻的挑战。战胜这一困难的策略之一是通过生物反应器在管腔表面预先接种内皮细胞,以阻碍血小板的粘附。
胶原蛋白可以通过从动物组织中提取或通过重组过程获得。这种材料很容易溶解,可以形成凝胶,能够包裹细胞,类似于在天然血管壁中观察到的 3D 微环境。然而,由于其机械强度较弱,构建的组织工程血管中呈现出非常低的爆破压力。针对这一点,科学家们使用1型胶原蛋白纳米纤维垫制成 2 mm 直径的管状移植物,然后与戊二醛交联,在植入大鼠下腔静脉后可稳定长达 12 周而无动脉瘤扩张。在一项研究中,与弹性蛋白和 PCL 等其他可生物降解材料的共静电纺丝提高了机械强度和生物活性。这些发现表明,胶原蛋白与其他合成材料的结合可以在未来提供更好的工程血管替代品。
3. 丝素蛋白
从 Bombyx mori 蚕茧中提取的丝纤维已用于各种生物医学过程,包括缝合线。丝的两种活性成分是丝素蛋白和丝胶,它们分别提供弹性和胶状特性。这种材料具有生物相容性、非血栓形成,并且在体内缓慢降解,因此,作为构建小直径血管导管的可行替代品脱颖而出。在之前的一项研究中,发现静电纺丝素蛋白具有足够的爆破强度,能够承受生理压力和良好的机械强度,可以抵抗动脉瘤的扩张和破裂。
研究表明用丝素蛋白构建的血管移植物,通过体平滑肌细胞和内皮细胞的迁移和增殖,拥有增强的生物活性。植入大鼠腹主动脉的丝素蛋白(1.5 毫米)移植物在长达 1 年的时间里显示出比 e-PTFE(30%)更高的通畅性(85%)。并且随着丝素蛋白的降解,细胞外基质蛋白的沉积增加,抑制动脉瘤扩张的机械性能增加。
4. 透明质酸 (HA)
透明质酸是一种非硫酸化糖胺聚糖,由 Meyer 和 Palmer 于 1934 年首次从玻璃体液中分离出来,由葡萄糖醛酸和 N-乙酰氨基葡萄糖组成。这种材料是透明的,可以通过微生物发酵大量合成。HA 是一种可快速生物降解、亲水、非粘性和生物相容性的天然聚合物。它可以在不引起任何异物反应的情况下调节细胞分化、迁移和血管生成,使其成为组织工程领域的一种卓越的材料。在之前的一项研究中,发现 HA 通过 CD44、ICAM-1 和 RHAMM 细胞受体促进内皮细胞的粘附和增殖,从而增强组织生长和修复。机械性能可以通过改性和交联程度来调节。也有科学家近年来将HA 和类人胶原蛋白相结合,产生了一种血管支架,其生物物理和机械性能增强,接近天然细胞外基质。
5. 纤维蛋白 (Fibrin)
纤维蛋白是一种不溶性蛋白质,经常参与组织修复和伤口愈合过程。它是由凝血酶激活的纤维蛋白原聚合形成的,从而产生纤维状网络凝胶。纤维蛋白支架可以帮助参与组织重塑的细胞的粘附、增殖和迁移。使用纤维蛋白凝胶的挑战之一是其机械性能差。
利用不同细胞预先接种培养的纤维蛋白支架,可以获得更好的机械性能。例如,骨髓来源的 SMC 祖细胞。另一种提高基于纤维蛋白的组织工程血管强度的技术是缺氧和补充胰岛素,这会增强包埋的新生儿真皮成纤维细胞的胶原蛋白沉积。然而,这种方法的缺点是由于在生物反应器中培养过程中长度的损失,无法生产具有适当临床长度的容器。
(四) 脱细胞天然支架
为了获得在结构和生物力学性能上都模仿天然脉管系统同时避免不良免疫反应的 TEVG,开发了一种脱细胞支架。去细胞化是在去污剂和酶的帮助下从组织中剥离抗原性细胞物质的过程,留下一个组织良好的无细胞基质作为自体细胞浸润和组织重塑的支架。
罗森伯格等人是第一个在 1960 年代使用牛颈动脉开发脱细胞血管假体的人。从那时到现在,许多基于自体移植物、同种异体移植物和异种移植物的脱细胞组织的临床产品已可用于心脏、眼科、牙科、皮肤和软组织等广泛应用。与替代合成导管相比,脱细胞异种移植物没有明显优势,除了脱细胞移植物的高加工成本外,两种移植物(合成和异种移植物)的通畅率相似,并且在感染或假性动脉瘤后移植物恢复的机会也较低。
基于脱细胞人类供体静脉的产品,例如用于动静脉瘘 (AVF) 的产品(SynerGraftTM,源自人类尸体静脉同种异体移植物)已上市,但尚未在临床领域广泛采用。在先前的一项研究中,这些移植物似乎对感染更具抵抗力,尽管与合成导管相比,动脉瘤扩张,但没有观察到通畅性的改善。与同种异体脱细胞基质商业化相关的有限供应和复杂的伦理/监管问题仍然是另一个挑战。
(五) 基于细胞的完全生物血管
生物血管主要是利用各种细胞来制造血管结构,目的是避免使用合成材料观察到的问题,例如炎症、狭窄和感染。目前,研发人员主要开发了三种方法:基于细胞片的方法、体内生物反应器和基于细胞环的方法。这几种方法,也各有优劣。
1. 细胞片法
细胞片方法涉及在抗坏血酸作为培养基的情况下扩大细胞群。将细胞监测到一定时期(成熟时间),然后小心地去除细胞层并放置在圆形管状结构上,然后进行长达8周的动态培养,以将各层统一为血管结构。研究人员利用不同的细胞来源构建了细胞层组织的人工血管,其爆破压力接近约 2600 mmHg,远高于隐静脉。在之前的一项研究中,通过这种方法获得的移植物可以在植入犬模型后作为股动脉介入承受生理压力。然而,生成 TEVG 所需太长时间体外处理(6 到 9 个月),以及高昂的制作成本,大大限制了这种方法的商业化可行性。
2. 生物反应器法
生物反应器方法是为生成人工血管而开发的另一种创新方法。在这里,身体充当生物反应器,通过在腹膜腔植入异物后引发炎症反应,从而触发纤维囊的形成。纤维囊主要由肌成纤维细胞和胶原基质层组成,由一层间皮细胞包裹,在脱细胞后可以作为人工血管使用。在之前的一项研究中,将硅橡胶管植入大鼠腹腔导致肌成纤维细胞包裹,形成胶原基质,2周后形成单层间皮细胞。拔管后,血管状结构由内而外翻转:间皮外层成为内膜;胶原蛋白和弹性蛋白层成为介质;外面的胶原蛋白层变成了外膜。随后,将移植物植入同一只大鼠的颈动脉位置,在大鼠体内能够保持通畅长达4个月。
在迄今为止评估的植入管中,发现聚乙烯管在 50% 的情况下可产生出色的可移植人工血管。虽然这种模型能够在短期开发人工血管,而无需担心抗原性的可行选择,但对于患者的两次侵入性手术,加上成熟期间组织粘附到腹膜壁的可能性,限制了这种方法的可行性。
3. 细胞环法
开发基于细胞环的方法,是为了克服通过利用由琼脂糖孔组成的模具,在培养后过程中剥离或操作可能损坏细胞片的困难。在这种方法中,高密度细胞悬浮在琼脂糖基质中以分泌细胞外基质ECM,从而充当血管导管形成的基石。之前的一项研究表明,来自成纤维细胞和内皮细胞的人体动脉在脉动流下沉积和调理长达 14 天,经由在 3 mm ID 模具中的机械刺激,产生了由细胞外基质ECM成分组成的血管状组织。同样,在将永生化大鼠主动脉 SMC 在琼脂糖孔(内径 2-6 毫米)中培养长达 2 周以产生融合组织环。这种方法已在小动物模型(大鼠)中进行了尝试。
4. 3D细胞打印
细胞环法的一个限制是制造的移植物的形状有限,生物打印就得以发展。使用生物3D打印这种新方法,可以开发针对患者的脉管系统。由于灵活性,一些研究已经采用这种方法来开发体外微血管化结构。已有研究者通过多细胞球体和圆柱体的精确沉积和合并,开发了简单和分支的脉管系统。在生物反应器中放置 21 天后,该结构的爆裂压力约为 773 mmHg。通过这种方法设计具有不同形状和层次树的血管的能力看起来非常不错,然而,长达7天的处理时间,以及全程无菌的需求,可能会成为此方法的难点。
04总 结
在未来,具有抗血栓特性和出色的生物相容性以及可定制的可降解性的增强型生物可吸收合成材料很可能成为小型血管手术的理想选择。然而,接近商业化的工程血管移植物的大部分成功是针对大血管而不是用作心血管旁路移植物的小直径移植物。上游的材料供应也是人工血管遭遇“卡脖子”的重要原因之一。 因此,人工血管的研发不仅仅要解决制造技术问题,在高端材料领域,也需要更多的动力来推进。在未来,血管工程领域仍然可供未来的创新者去发掘钻研,迎接挑战以创造更多功能性小直径动脉替代品。
资料来源:
[1] Obiweluozor, Francis O., et al. "Considerations in the development of small-diameter vascular graft as an alternative for bypass and reconstructive surgeries: a review." Cardiovascular Engineering and Technology 11.5 (2020): 495-521.
[2] Saito, Junichi, et al. "Challenges and possibilities of cell-based tissue-engineered vascular grafts." Cyborg and Bionic Systems 2021 (2021).
[3] Unnikrishnan, Madathipat, et al. "The making of indigenous vascular prosthesis." The Indian Journal of Medical Research 143.6 (2016): 769.
[4] Blume, Cornelia, et al. "Vascular implants–new aspects for in situ tissue engineering." Engineering in Life Sciences 22.3-4 (2022): 344-360.

来源:思宇MedTech


