您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-09-27 13:32
当“创新”已成为刻在成长基因里的本能,当“国产替代”在各重要细分赛道逐步实现,拓展海外业务与实现国际化布局,俨然已成为新时代本土医疗器械企业发展的新使命。翻开医疗器械产业群雄逐鹿的世界地图,在越来越多的国际化竞争高地,中国企业的身影屡现。
“出海”,是医疗器械企业发展的全新征途!
01我国医疗器械行业进出口概况
2021年,我国医疗器械进出口贸易总额1440.87亿美元,同比下降16.87%,出口额为994.09亿美元,同比下降24.73%,进口额446.78亿美元,同比增长8.31%;其中医院诊断与治疗进出口额657.29亿美元,一次性耗材进出口额434.29亿美元。
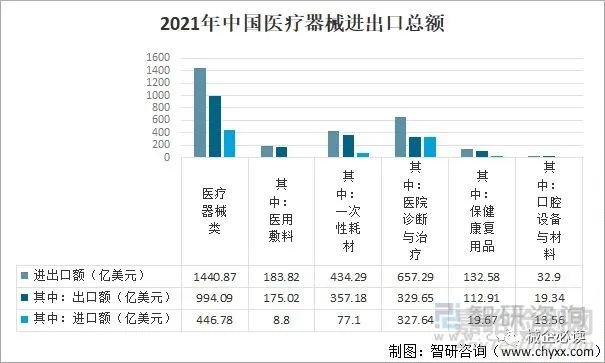
2021年中国医疗器械进出口总额
从出口市场来看,我国医疗器械出口韩国24.57亿美元,同比下降4.42%;出口越南18.28亿美元,同比增长40.16%;出口意大利16.76亿美元,同比下降58.29%;出口泰国15.99亿美元,同比增长88.53%;出口印尼14.85亿美元,同比增长39.09%。
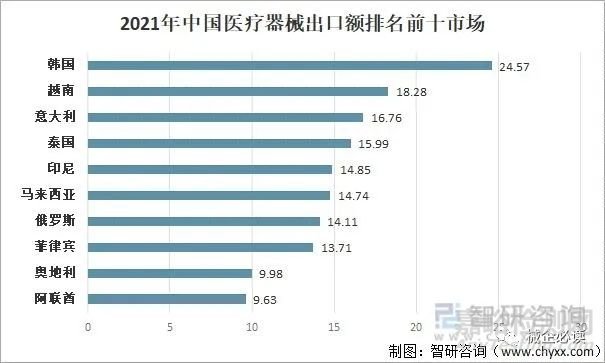
2021年中国医疗器械出口额排名前十市场
从整个市场规模和增幅来看,泰国都是拓展海外业务与实现国际化布局优选之地。
虽然泰国医疗器械市场规模在东盟国家首屈一指,但本国医疗器械自给率极低,90%的在用医疗器械都是来自进口。因此,泰国的市场潜力显而易见,国内医疗器械制造商可以考虑布局泰国市场。
根据美国商务部的报告,目前,泰国总进口市场规模在7.26亿美元左右,需求极大的进口医疗器械产品依次为:
(1)普外科手术器械产品、成像诊断仪:市场规模约3.29亿美元
(2)各种X线机:市场规模约1.42亿美元
(3)整形外科器械、植入式器械和心脏瓣膜等产品:市场规模约1.39亿美元
(4)牙科器械和义齿材料等:市场规模约6880万美元
(5)各种康复器械产品:市场规模约5720万美元
泰国医疗器械进口订单中的60%来自公立医院,40%来自私立医院和疗养院。美国、日本、中国和德国是泰国的4大医疗器械进口来源国。其中,美国约占29%的份额,日本占17%,中国占15%,德国占14%。
02泰国医疗器械监管机构及法规要求
泰国的医疗器械受泰国公共卫生部 (MOPH) 下属的泰国食品和药物管理局 (TFDA) 监管。
2021年,泰国食品和药品管理局(TFDA)修订了其医疗器械法规。
根据新法规的要求,医疗器械分为四类——I、II、III 和 IV。新法规还包括分组规则,允许将医疗设备和 IVD 分组。医疗器械分组是将相关产品组合在一起并在同一申请中注册。
根据旧法规(2008 年医疗器械法 (BE 2551)) ,90%的器械被归类为通用器械,不需要TFDA详细审查。相反,修订后的法规(医疗器械法/条例 BE 2562 (2019) (第二版)),与东盟地区医疗器械指令(AMDD)一致,大多数器械现在处于TFDA的审查之下,需要通知或注册。
03泰国医疗器械认证模式
低风险的普通 I 类设备必须在泰国进口和销售之前列名,而 II 类和 III 类设备必须先通过文件预审,IV 类设备必须获得批准的许可证才能投放泰国市场。
II、III 和 IV 类器械需要按照东盟 CSDT 格式提交技术档案。I 类无菌和测量设备需要提交测试报告才能将这些设备投放市场。
(一)I类设备备案所需文件:
(1) 载明医疗器械名称和说明、标签、产品规格、医疗器械生产信息或者产品
(2) 所有人详细信息的文件,包括医疗器械附注文件;在有医疗器械文件的情况下。
(3) 在境外注册的境外注册历史文件;
(4) 生产或者进口无菌医疗器械的无菌试验证明文件;
(5) 用于测量的医疗器械生产或者进口时的测试或者校准证明文件;
(6) 产品生产者或者所有者的产品合格证明;
(7) 产品所有人在提交医疗器械进口申请时作为代理人的授权书;
(二) II类/III/IV类设备通知所需文件:
(1) 医疗器械的名称和说明文件、医疗器械的标签和标签文件、医疗器械的摘要、医疗器械的生产信息或者产品所有人的详细信息;
(2) 医疗器械安全性和功能性的主要原则及其一致性证明方法的文件;
(3) 风险分析文件;
(4) 质量体系证书;
(5) 产品生产者或者所有者的使用目的、适应症、包装、标签证明和使用方法证明;
(6) 产品生产者或者所有者的产品合格证明;
(7) 生产企业或者产品所有人的医疗器械销售记录证明;
(8) 其他证明文件
(三)认证流程
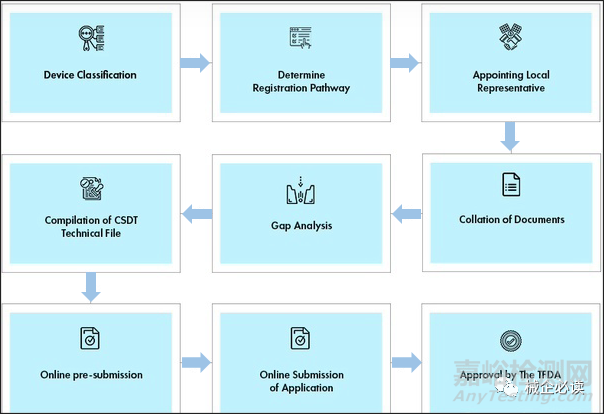
参考资料:
[1]518医疗器械网:泰国医疗器械进口活跃.
[2]产业前景:2021年中国医疗器械行业进出口概况及发展趋势分析.
[3]医疗器械认证:医疗器械出口泰国不再接受FSC!

来源:械企必读


