Corvia Medical宣布开启新的临床研究RESPONDER-HF。RESPONDER-HF是一项随机、假对照试验,包括来自美国、欧洲和澳大利亚60个中心的260名患者。本项研究是一项针对射血分数保持(HFpEF)或轻度降低(HFmrEF)的心衰患者的Corvia心房分流器IASD全球验证性试验。旨在评估IASD心房分流术减少心力衰竭住院率和改善生活质量(QoL)的效果。
本项研究已经在俄亥俄州立大学Wexner医学中心完成第一例患者入组。
RESPONDER-HF研究对于 Corvia Medical非常重要一项临床研究。由于年初REDUCE LAP-HF II 阴性结果,导致整个行业对心房分流器持怀疑态度。当然 Corvia Medical一直解释,尽管试验不成功,但是REDUCE LAP-HF II中最大亚组(肺血管阻力正常的患者)获得明显高于假对照组临床收益。
这样解释相对缺乏底气,因此Corvia Medical决定开展新的临床研究,来证实REDUCE LAP-HF II 中部分有利于心房分流器研究结果。REDUCE LAP-HF II 需要持续9年,研究完成日期在2031年。按照这个时间周期,IASD想要获得FDA批准需要等待很多年。
PI评价
“我们致力于证明心房分流治疗的潜在益处,并预计RESPONDER-HF将验证REDUCE LAP-HF II应答者组的发现,这相当于三分之二的HFpEF患者,或仅在美国就有200万人。”
----Martin Leon Columbia University Irving Medical Center
“ESPONDER-HF研究不仅将继续推进我们对HFpEF分流的科学理解,而且有可能改变治疗范式,这样做将使我们向心力衰竭的精准医学迈进一步。”
----Sanjiv Shah Bluhm Cardiovascular Institute
不过IASD很可能错失第一款获FDA批准上市的心房分流器。目前心房分流器领域走得最快的无疑是V-Wave的V-Wave Ventura Shunt,其IDE研究( RELIEVE-HF )将在明年完成 Primary Completion Date,在2027年完成临床研究 。只要 RELIEVE-HF 不出现阴性结果,V-Wave Ventura Shunt抢在IASD前在美国上市概率非常高。
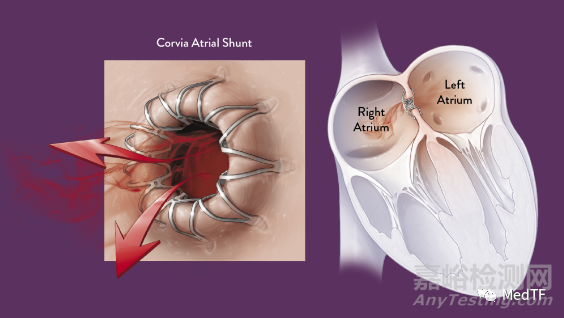
InterAtrial Shunt Device (IASD)
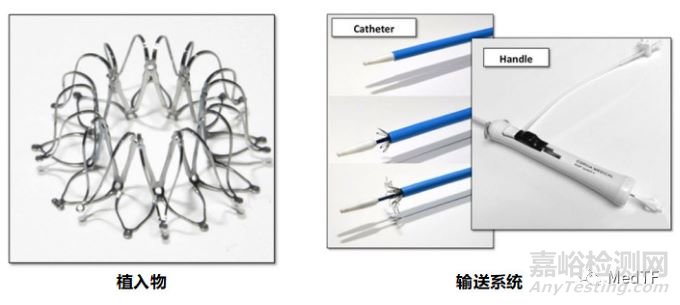
IASD是首款获得CE批准上市的心房分流器,其是一款经股静脉及房间隔治疗心衰产品。IASD是一种在微创手术中植入的硬币大小的植入物,旨在在左右心房之间形成通道。通过允许左心房减压,IASD可以解决导致心力衰竭症状的升高的压力。IASD由植入物和推送系统两部分构成;
其中植入物是一件类似于自扩张的金属笼,双盘设计,中心有一个开口。植入物是具有X射线显影和超声反馈,使其在植入过程能够通过影像观察。植入物的每一侧都有9条腿,并且其中LA侧在每条腿的末端具有显影设计。植入物的LA侧是平坦的,以允许腿与LA壁平齐,从而使植入物展开时LA轮廓最小。右心房侧弯曲以适应可变的隔膜壁厚度,仅腿部末端接触右心房壁。完全扩张时植入物的外径为19.4mm,内径为8mm。
Corvia Medical
Corvia Medical是一家致力于通过开发革命性的结构心脏器械,来彻底改变心力衰竭的治疗方式的公司。 IASD是世界上第一个经欧盟批准用的公司于治疗心力衰竭的经导管器械,用于治疗HFpEF或HFmrEF。目前 IASD已经获得FDA批准在美国开展PMA相关的临床研究。