据统计,在美国每个被批准上市的新药,平均研发成本高达20亿美元,平均研发周期超过10年。
而且新药研发的成功率⾮常低,有很多药品从概念到成功上市,成功率只有5%,可谓是「百⾥挑⼀」。每个成功上市的新药背后,都凝聚着众多专家,投资⼈和企业的心血。为了保证市场的健康成长,同时⿎励创新和研发,美国食品与药品管理局(Food and Drug Administration, FDA)制定了⼀系列非常完善的监管手段。
在美国,⼀个普通的新化合物从最初的发现到申请上市,大约需要经过15年的时间,其中 FDA 用于审评的时间大约为6到10个月。美国的联邦食品、药品、化妆品法案 FDCA(Federal Food, Drug and Cosmetic Act)规定了新药审评的过程,此法案有关新药审评最重要的条款相当简单明了。
FDCA 规定,任何⽤于诊断、治愈、缓解、预防人、其它动物疾病的物品,以及用于影响⼈、或其它动物身体的结构、或功能的物品(⻝品除外)为药品。
FDCA 还规定,任何新药在上市之前⼀定要表明它是安全、有效并且经过审批的。
新药申请条件
符合以下任何情况均可以向 FDA 提出 NDA 申请:
1、新分子实体(NME)
2、新化学实体(NCE)
3、原批准药品相同化学成分的新盐基、新酯基
4、原批准药品的新配方组成
5、原批准药品的新适应症(包括处方药转非处方药使用)
6、新剂型、新给药途径、新规格(单位含量)
7、两种以上原批准药品的新组合
新药注册途径
505(b)指的是 FDCA 第5章第505分章,即505法案。
505法案包括NDA的3种申请:
1、505b1:申报者进⾏所有药学研究(Completely new)
2、505b2:同样也是申报者进⾏所有药学研究,但不同的是部分信息不实由申报者⾃⼰完成(by),或者这些研究不是为了申报者⽽完成的(for);以及申报者没有引⽤的权利(Hybrid new, Some studyyoucan bridge)
3、505j:欲申报制剂在 API,剂型,给药途径,标签,质量,检验,适应症上都和已有品种⼀样。(Generic, ANDA)
505j 是 ANDA 的注册申请途径,申请流程与 NDA 有所不同,我们今后会详细单独描述,本⽂主要总结整理NDA 的注册申请程序。
(图:新药注册途径)
新药申请程序
美国每年上市许多新药,虽品种不同,FDA 对它们的评审要求也各不相同,但评审框架是⼀致的,大致可为以下几个步骤:
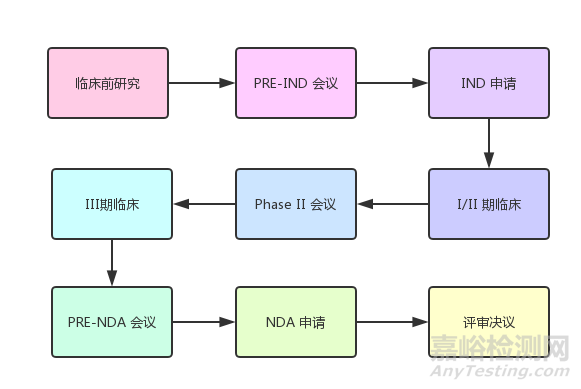
(图:新药申请程序)
1. 临床前研究
新药安全、有效性的研究最终将在⼈体上进⾏,但在FDA允许试验药物试⽤于人体之前,必须证明该药的研究对⼈体是安全的。如果新药申请者不能从现有的研究数据、本国及他国的使⽤等数据证明该药是安全的,那么就必须要进行临床前研究。
在这阶段,FDA⼀般规定(最低限度)新药申请者必须:
① 完成该药的药理研究
② 在⾄少⼆种动物身上进行急毒试验
③ 按照该药预想的用途进行为期二个星期至三个月的短期研究
需要指出的是,一旦临床前研究结束,动物试验并没有结束随之完成,许多时间更长、更专项的研究如慢性、抗癌试验将在整个新药申请过程中进行动。
临床前研究用来评估:
① 药品的药理学现象和作用机理(MOA)
② 药物毒性特征和毒性靶器官
③ 药物吸收、分布、代谢和排泄(ADME)
2、提出新药临床试验申请(IND)
当申请者认为药品已具有足够的数据证明该药品是安全时,需要向 FDA 提交新药临床研究申请(IND)。IND 的申请相当于新药申请者获得 FDA 的许可,可以开始在⼈身上进行试验。
在临床研究申请中,新药申请者必须提交至少两个领域的材料。首先,申请者必须向 FDA 公布所有临床前研究的结果,提供该新药组成的信息,以及该新药的生产与质控程序。
其次,申请者还必须提供临床研究的计划书,并在计划书中详细叙述新药申请者希望进行的临床研究以证明该药用于人体的安全性、有效性。同时,与临床研究相关的其它材料包括研究者资格等也必须包括在内。
按照现行规定,FDA 有30天的时间来决定是否允许该药进行人体试验,同时 FDA 还将评价临床计划书。临床研究计划要保证临床受试者不应受到不必要的危险以及有希望证明该新药⽤于人体是安全、有效的。
如果在提交 IND 后的30天内,FDA 没有同新药申请者联系,那么临床试验就可以开始。当然,新药申请者在开始临床研究之前最好还是应当主动同 FDA 取得联系。
⼀旦 FDA 作出决定临床研究不应开始,通知会在30天内发出,临床试验会被推迟直到相关问题得到解决。⼀般来说, FDA 发出「临床试验暂停通知」,主要会有以下几个原因:
① 临床前研究未能证明该药⽤于⼈体会是安全的
② 临床前研究未符合 GLP 及其它相关标准
③ 所建议的临床研究计划书不完整、临床研究不安全
如果申请人在申请 IND 后的两年内仍没有按计划开始临床研究,或该 IND 的临床试验被中止叫停超过一年,FDA 便会将此 IND 列为「失活状态」(Inactive Status)。一旦 IND 被置于「失活状态」,所有临床研究者都必须被通知到,并按照21CFR 312.30的要求将临床研究用药品退还给申请⼈或立即毁。
IND分为以下两个类别:
① 商业性 IND(Commercial IND)
商业性 IND 是指为申请新药上市目的而申请开展的全新临床试验。IND 的申请人通常与企业进⾏合作。商业性 IND 中有⼀种情况被称作「探索性 IND」(Exploratory IND)或「筛查性 IND」(Screening IND),作为递交的第一个申报文件以支持对新药开展最早的1期临床研究。
② 非商业性IND(Non-Commercial IND)
非商业性IND是由医生自行开展的研究,该研究旨在研究药品对特定人群的疗效或为无药可治的患者提供未经批准的药物治疗。非商业性IND包括有研究性IND(InvestigatorIND/Research IND)。
IND申报文件包主要包括9部分的内容:
1、首页函、FDA 1571表
2、目录
3、引⾔和总体研究计划
4、研究员手册
5、临床研究⽅案
6、化学、生产和质量控制信息
7、药理和毒理信息
8、已有人体临床经验
9、额外信息
在IND申报文件包中,还需提交相关原始完整研究报告,如毒理研究报告等。
(图:IND申请流程)
3、临床试验
如果FDA批准IND申请,临床试验(由人类受试者参与的研究)可以开始。
① 1期临床:严格控制药物在少量的健康志愿者身上进行,大约有20—80例。这阶段的试验主要是获得药物的基本的安全性数据、以及药理信息。受试者一般为健康志愿者。
② 2期临床:试验药物在一小部分受试者身上进行,大约为100到200例。这些病⼈是患有该药物预设所治的疾病。这个阶段进一步提供了该药的安全性数据,用于建议用途的第一个适应症使用该试验药的有效性。如果新药申请者能够从该药的使用、或之前的临床研究得出结果该药用于临床是安全的话,⼀期临床甚至某些情况下的二期临床可以省去。
③ 3期临床:参与受试者有数百⼈到数千⼈,重点考察药物的安全性和有效性。试验药物在较多的受试者之间进行,这些受试者患有该药物预设所治、诊断、预防等的疾病。在开始本阶段研究之前,新药申请者必须向 FDA 提交从一、二期临床试验中的数据以表明该药是有理由安全、有效的以及具有有利的效益/风险比。
关于 End of Phase IIA meeting(EOP2A)会议
① 在II期临床试验完成以后,FDA强烈建议申请人在开始III期关键性临床试验之前,提出 EOP2 会议。EOP2A 会议发生在临床试验获得在拟定适应症中的剂量反应关系后,包括剂量范围对安全性、生物标志物和概念性验证的影响;通常发生在I期临床试验完成和第⼀批患者暴露-反应试验之后和IIb期(如患者剂量范围试验)和III期临床有效性安全性试验之前。
② EOP2A 有助于帮助申请人找到最佳剂量,节约成本,将后期临床试验的成功率最⼤化。为了能够充分利用 EOP2 会议与 FDA 进⾏沟通,在会议开始一个月之前,申请人应向 FDA 提交一个会议文件包:
1、会议请求与会议信息
2、日期、时间和参会者
3、总结所有更新的数据(临床, CMC, 药理/毒理等)
4、提出 Phase III 开发计划
5、提出可能使⽤的药物标
6、问答
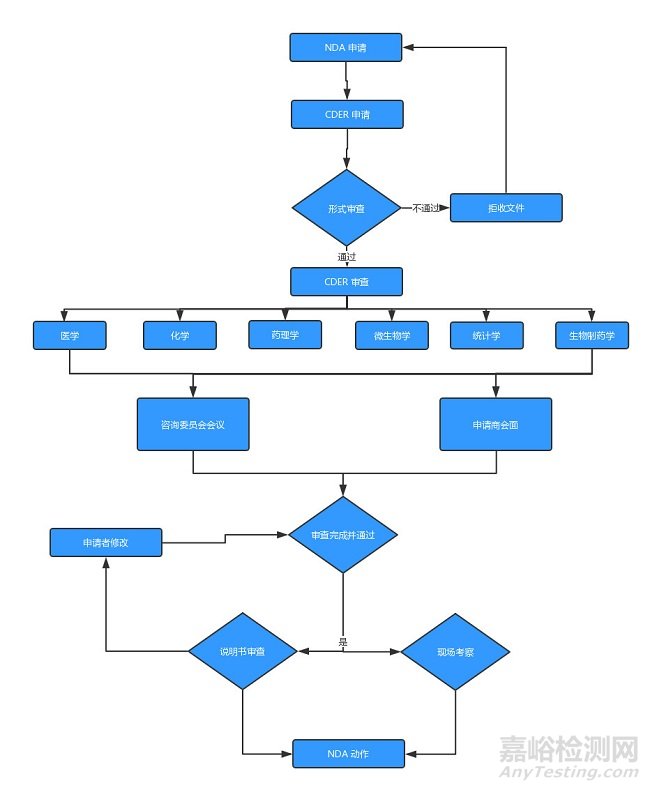
4、新药申请(NDA)
临床试验结束之后,药物申请者可提交一份 NDA,申请批准这款药物在美国销售。FDA 根据药品的治疗特性,在审查程序上分为「标准审查(Standard Review,SR)」和「优先审查(Priority Review,PR)」两类。
对「能够在治疗、诊断或疾病预防上⽐已上市药品有显著改进的新药」,FDA 对非常重要的 NDAs 在6个⽉内进性行审评,新药的标准审评时间是10个月。FDA根据《政策和程序⼿册》(Manual of Policiesand Procedures,MAPPs)相关规定可采取「优先审查」(Priority Review),评审时间由标准审查的10个月缩短为6个月。NDA评审是最严格、耗时的过程,而且只有很小比例的试验药最终能允许进入了市场。
此外,FDA还通过快速通道(FastTrack)来鼓励药物创新和加快审查⽤于治疗严重或威胁⽣命疾病或尚未满⾜临床治疗需求的新药,例如艾滋病、阿尔兹海默病、心衰、肿瘤、癫痫、抑郁症和糖尿病等。一旦符合快速通道(Fast Track)的药品,FDA必须在60天内做出决策。
(图:INA申请流程)
5.新药上市后的监测
药物被批准之后,药品的标签可能进行变更,内容包括药物副作用的新信息。药物申请者需要提交安全性变更,医⽣或患者也可以向 FDA报告有关药物的严重不良事件。引起更严重、超出预期副作用的药物在必要的情况下要从市场撤市。
6.NDA 申请费用 PDUFA
PDUFA 即《处方药申报者付费法案》,FDA 依据该法案向制药商/申报者收取一定的审查费用。PDUFA 费用主要包括三部分:
1、申请费
2、生产设施费
3、产品费
法案同时也规定,PDUFA 费用只针对新药申请阶段(NDA)收取有关费用,而对于临床前研究(PreIND)申报资料的审评,是不收取有关费用的。
费用的免除、削减和退还PDUFA 条款中也指出,当免除费用的决定有助于公众健康和安全、费用收取会给药品创新带来障碍、或者所收费用超过审查成本时,FDA 可做出免除、削减或退还收费的决定。
References:
[1]《读懂 FDA 药品注册》
[2]《如何获得 FDA 批准》
[3]《FDA 官方网站》