今日头条
杭州壹瑞Kv1.3抑制剂获批临床。杭州壹瑞医药自研创新药YR-001获FDA批准开展临床试验(NCT05718921)。YR-001是一款高选择性钾离子通道Kv1.3小分子抑制剂,已在数种自身免疫性疾病的临床前模型中显示出治疗潜力。去年6月,礼来从D. E. Shaw Research (DESRES)公司引进一款临床早期的小分子Kv1.3抑制剂DES-7114的全球开发权益,拟开发用于溃疡性结肠炎、克罗恩病和特应性皮
炎等自身免疫性疾病的治疗。
国内药讯
1.瑞科新佐剂带状疱疹疫苗上I期临床。瑞科生物开发的新佐剂重组带状疱疹疫苗REC610在I期临床中完成首批受试者入组。临床前研究显示,REC610具有较好的免疫原性,可诱导产生高水平的gE抗原特异性CD4+T细胞反应和IgG抗体,其免疫反应非劣于对照疫苗Shingrix®(葛兰素史克)。瑞科生物计划评价REC610在40岁及以上健康成人受试者中的安全性和免疫原性,Shingrix®为阳性对照药物。
2.亘喜双靶点CAR-T国内获批临床。亘喜生物靶向BCMA/CD19双靶点自体CAR-T产品GC012F获国家药监局批准,拟开展Ⅰ/Ⅱ期临床评估用于治疗复发/难治性多发性骨髓瘤(RRMM)的安全性与有效性。值得一提的是,本月初,该新药已获得FDA的临床批件。公布于ASH 2022年会上的中国Ⅰ期临床长期随访数据显示,GC012F达到100%的总体应答率(ORR),100%受试者达到微小残留病灶(MRD)阴性。
3.必贝特PPAR激动剂获批PBC临床。必贝特医药1类化药BEBT-503胶囊获国家药监局批准,即将开展用于治疗原发性胆汁性胆管炎(PBC)的II期临床试验。BEBT-503是一款高活性泛PPAR激动剂,此前已获批开展治疗2型糖尿病合并非酒精性脂肪肝病的II期临床试验。来自澳大利亚I期临床结果显示,BEBT-503具有良好的安全性,有望为原发性胆汁性胆管炎尤其是对熊去氧胆酸应答不佳或无应答的PBC患者提供新的治疗选择。
4.亿腾景昂CDK7抑制剂报IND。亿腾景昂1类新药EOC237胶囊的临床试验申请获CDE受理。这是亿腾景昂首个自主研发的项目,是一款高选择性CDK7抑制剂,拟开发用于晚期实体瘤。CDK7是细胞周期调控和转录调节的关键靶点,与乳腺癌、前列腺癌、小细胞肺癌、卵巢癌、胰腺癌、结直肠癌、胃癌、神经母细胞瘤及白血病等多种肿瘤的发生、进展及耐药密切相关。
5.合肥天港PVRIG单抗报IND。合肥天港免疫1类生物制品NM1F注射液的临床试验申请获CDE受理。NM1F是一款基于IgG1亚型的PVRIG单抗。临床前研究显示,该抗体具有更长的半衰期和高耐受剂量。同时,体内药效实验显示该抗体单用就具有显著的抗癌功能,与抗PD-1单抗联用,能够进一步增强抗癌免疫力。NM1F为国内继君实生物之后第2款PVRIG单抗。
6.药明生物2022年总收入增长48.4%。2月13日,药明生物公布2022年业绩预告。根据初步评估,公司年度所收益较去年同期增长约48.4%;利润及归属于公司权益股东的利润相比于去年同期分别增长约29%及约30%;经调整股份为基础的薪酬开支、外汇损益及股权投资损益后,非国际财务报告准则经调整纯利将增长约47%。
国际药讯
1.阿柏西普再获FDA批准新适应症。再生元眼科明星产品VEGF抑制剂Eylea(aflibercept)获FDA批准用于治疗早产儿视网膜病变。Aflibercept通过阻断参与血管生成的生长因子VEGF-A与胎盘生长因子(PLGF),进而阻断新生血管生成,并降低眼内血管通透性。此前,Eylea已被批准用于治疗湿性年龄相关性黄斑变性(AMD)、视网膜静脉阻塞(RVO)后黄斑水肿、糖尿病性黄斑水肿(DME)和糖尿病视网膜病变(DR)。
2.Ironwood公司便秘药获优先审评资格。Ironwood公司鸟苷酸环化酶-C(GC-C)激动剂Linzess(linaclotide)的补充新药申请(sNDA)获FDA受理,用于治疗6-17岁儿童功能性便秘(FC)。FDA同时授予其优先审评资格,预计今年6月14日前完成审查。在Ⅲ期临床中,linaclotide较安慰剂显著改善患者的自发肠道运动频率(SBMs/周),该治疗组患者12周时自发肠道运动频率从基线起最小二乘均值改变(2.220)与安慰剂组(1.050)相较超过2倍(p<0.0001)。
3.溶瘤病毒联合治疗三阴性乳腺癌临床积极。安进基于改良的1型单纯疱疹病毒(HSV-1)的溶瘤病毒疗法talimogene laherparepvec(T-VEC),联合标准化疗用于三阴性乳腺癌患者术前治疗的Ⅱ期临床最新结果发布在 Nature Medicine期刊上。37例患者在手术前接受T-VEC溶瘤病毒联合标准化疗。治疗后使用残余肿瘤负荷(RCB)来评估治疗效果,45.9%的患者(17/37)在治疗后获得完全缓解,治疗后两年内,89%的患者(33/37)没有疾病复发。
4.辉瑞/BioNTech带状疱疹疫苗上I/II期临床。辉瑞与BioNTech公司联合开发的带状疱疹mRNA候选疫苗启动一项I/II期临床(NCT05703607)。该项研究将招募900例50岁至69岁的健康志愿者。I期阶段旨在为II期研究选择最佳的mRNA疫苗候选物、剂量水平、接种时间以及疫苗配方。该研究的阳性对照组为GSK的Shingrix,该疫苗2022年全球销售额达29.58亿美元。
5.曲拉西利一线结直肠癌III期临床失败。G1 Therapeutics公布CDK 4/6抑制剂曲拉西利+FOLFOXIRI+贝伐珠单抗三联疗法治疗转移性结直肠癌(CRC)的III期PRESERVE 1试验关键结果。与安慰剂相比,trilaciclib显著降低患者严重中性粒细胞减少症的发生率(1%vs20%)和严重中性粒细胞减少症平均持续时间(0.1天vs1.3天)。不过早期抗肿瘤疗效数据显示安慰剂组的客观缓解率更高(61%vs50%)。鉴于安慰剂的疗效优于trilaciclib,该公司决定终止该项试验。
6.赛诺菲全球研发主管辞职。赛诺菲宣布公司全球研发主管John Reed博士将辞职,首席医疗官和全球开发负责人Dietmar Berger将临时接替John,管理研发团队。自2018年加入赛诺菲以来,John为公司的研发转型奠定了基础。他帮助赛诺菲重新定位了新疗法的发现和开发,并对治疗领域做了严格的优先排序和资源重新分配。2023年,赛诺菲将推出两款首创或同类最佳药物,以满足血友病和呼吸道合胞病毒的主要需求。
医药热点
1.辽宁向省属医院预拨补助资金10.4亿元。近日,辽宁省财政部门预拨2023年省属医院取消药品加成、重点专科建设等补助资金,以及一季度基本公共卫生服务和基本药物制度补助资金10.4亿元,帮助公立医院和基层医疗卫生机构及时缓解阶段性运行压力。此外,辽宁采取年初先行预拨、年底结算的方式,拨付省财政专项奖补资金1亿元,激励县级公立医院和基层医疗卫生机构有效保障医务人员工资薪金。
2.2027年全球药品市场预测总规模1.9万亿美元。2月9日,发表在Nature Reviews Drug Discovery上的IQVIA年度《The Global Use of Medicines 2023》报告显示,全球药品市场规模未来5年将以每年3%–6%的速度增长,2027年预计将达到1.9万亿美元。从不同治疗领域来看,预测2027年销售收入“名列前茅”的领域依次是肿瘤、免疫疾病、糖尿病和心血管疾病。
3.北京最大制药CDMO基地正式投产。2月14日,北京昭衍生物宣布,其位于北京经济技术开发区的“北京亦昭生物医药中试研发生产基地”正式竣工投产。据悉,该项目占地120余亩,预计总投资将超30亿元,是北京目前最大的制药CDMO服务基地。该项目分三期实施,其中一期建筑面积14.25万平方米,规划有17栋生产设施及辅助设施,已于2023年2月竣工投产,一期首批10条2000L规模原液生产线已投入使用。
评审动态
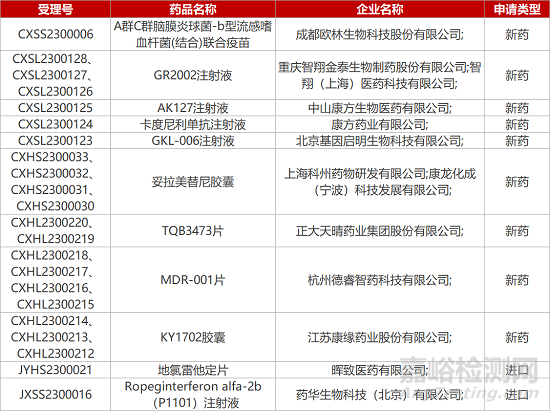
1. CDE新药受理情况(02月14日)
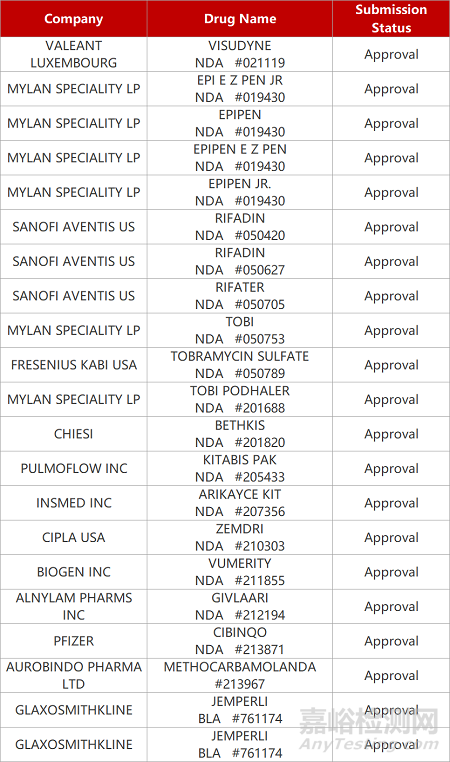
2. FDA新药获批情况(北美02月12日)