您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2023-03-01 11:55
子宫输卵管造影球囊导管用于将造影剂注入子宫腔和输卵管,进行子宫输卵管造影。使用子宫输卵管造影球囊导管进行造影时,输卵管如有阻塞、粘连等症状,会伴随有一定的疏通效果,但子宫输卵管造影球囊导管主要预期用途为造影诊断而非疏通治疗。
一、子宫输卵管造影球囊导管的器械组成与工作原理
子宫输卵管造影球囊导管通常由导管、球囊、阀门、接头等组成,可配有引导导丝、罗伯特夹、球囊充起组件作为配件。导管包括充起腔和注液腔,球囊为单球囊或双球囊。导管和球囊一般由高分子材料制成,如硅橡胶、乳胶、聚氯乙烯等。产品以无菌形式提供,一次性使用。
见图1。
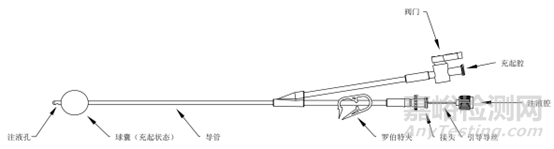
单球囊产品A
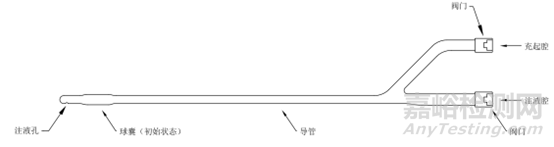
b 单球囊产品B
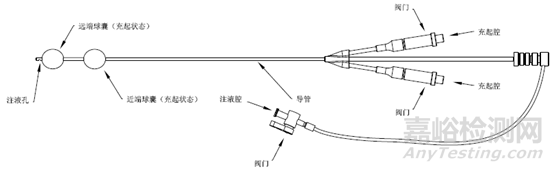
c 双球囊产品
图1 子宫输卵管造影球囊导管示意图
子宫输卵管造影球囊导管的规格标记建议用下列方法表示:
导管用其外径(mm)表示规格,球囊容积以毫升(mL)表示,可同时给出其他规格标记,如法国规格(Fr),并在产品技术要求中注明。
将产品置入子宫腔,使产品的球囊位于子宫颈内口的位置,通过充起腔给球囊注液膨胀封堵住子宫颈,防止造影剂从子宫腔外泄,再通过注液腔向子宫腔内注入造影剂,使子宫腔和输卵管显影,从而了解子宫腔和输卵管内情况。
二、子宫输卵管造影球囊导管主要风险
根据YY/T 0316《医疗器械风险管理对医疗器械的应用》附录E,列举了子宫输卵管造影球囊导管产品可能涉及的危险(源)(见表1),还应根据自身产品特点确定其他危险(源)。
表1 危险(源)、可预见的事件序列、危险情况和可发生的伤害之间的关系示例
|
危险(源) |
可预见的事件序列 |
危险情况 |
伤害 |
|
物理危险(源)
|
导管前端端头过长;端头过于锐利;导管有毛刺;导管连接不牢;导管堵塞或漏液;接头不匹配;球囊充起位置不当;无法注入液体充起球囊;球囊无法正常回缩等 |
使用过程中损伤子宫或无法使用 |
造成损伤、感染或额外伤害 |
|
生物学和化学危险(源) |
原材料控制不严;生产过程中引入的加工助剂未经过生物安全性评价;生产环境控制不严;清洗不合格;采用不适宜的灭菌方式或灭菌不彻底;灭菌过程及残留物控制不严;包装破损;产品使用完未按医疗垃圾处理等 |
生物相容性不符合要求、被污染的产品与人体接触;有菌或有毒物质影响环境 |
产生刺激、过敏、感染等危害;造成环境污染或交叉感染 |
|
操作危险(源) |
由缺乏技术或未经培训的人员使用,操作不规范;导管及导丝使用不当对宫腔造成损伤;球囊充起体积不合适,导致无法固定;球囊充起体积超出设计要求导致球囊破裂、漏液;乳胶产品使用液体石蜡、凡士林等石油基质润滑剂导致球囊破裂;球囊中生理盐水无法排空导致产品拔出困难;产品型号规格选用错误导致无法固定;产品被重复使用等 |
使用过程中损伤子宫或无法使用 |
造成损伤、感染或额外伤害 |
|
信息危险(源) |
产品操作说明描述不清;禁忌证和注意事项描述不清;缺少一次性使用医疗器械重复使用时会产生危害的警告等 |
操作人员不能正确使用产品 |
无法实现预期用途或感染 |
三、子宫输卵管造影球囊导管性能研究实验要求
常见的技术指标包括但不限于:
(1)外观与尺寸;
(2)物理性能:强度,球囊可靠性,球囊回缩性能/液体回收率,耐弯曲性,阀门(如适用)的可靠性,接头(如适用)的要求,若含有其他配件,应制定相应的性能指标。如:含有球囊充起组件,应参考GB 15810中适用部分制定相应性能指标;
(3)化学性能;
(4)无菌;
(5)环氧乙烷残留(如适用);
1、化学和物理性能研究
应当开展产品性能研究以及产品技术要求的研究,明确包括功能性、安全性指标(如化学性能、物理性能、微生物性能)的确定依据,所采用的标准或方法、采用原因及理论基础。
2、生物相容性评价研究
正常使用条件下子宫输卵管造影球囊导管直接与人体接触,应参照GB/T 16886.1《医疗器械生物学评价第1部分:风险管理过程中的评价与试验》对子宫输卵管造影球囊导管进行生物学评价,至少进行体外细胞毒性、刺激、皮肤致敏的生物学评价研究。
生物相容性评价研究应当包括:生物相容性评价的依据和方法;产品所用材料及与人体接触的性质;实施或豁免生物学试验的理由和论证;对于现有数据或试验结果的评价。
3、灭菌工艺研究
明确产品灭菌方法的选择依据并验证。器械的灭菌应通过GB 18279.1、GB/T 18279.2确认并进行常规控制,无菌保证水平(SAL)应保证达到1×10-6。灭菌过程的选择应至少考虑以下因素:产品与灭菌过程的适应性;包装材料与灭菌过程的适应性;灭菌对产品安全有效性的影响。
若灭菌使用的方法易出现残留,应明确残留物的名称、限量及其确定依据、采取的处理措施及进行相应的残留量检测。
4、产品货架和包装研究
4.1有效期研究
产品货架有效期是指产品在一定的温度、湿度、光线等条件的影响下保持其物理、化学、生物学性质的期限。有效期的研究应贯穿于产品研究与开发的全过程,在产品上市后还应继续进行有效期的研究。
货架有效期包括产品有效期和包装有效期。产品有效期验证可采用加速老化或实时老化的研究,应遵循极限试验等原则;加速老化研究试验的具体要求可参考YY/T 0681.1。
对于包装的有效期验证,建议开展在选择恰当的材料和包装结构合格后的最终成品包装的初始完整性和维持完整性的检测。在进行加速老化试验研究时应注意产品选择的环境条件的老化机制应与在实时正常使用环境老化条件下真实发生产品老化的机制一致。
4.2包装研究
产品包装验证可依据GB/T 19633、YY/T 0681系列标准等开展产品的包装验证。包装材料的选择应至少考虑以下因素:包装材料的物理化学性能;包装材料的毒理学特性;包装材料与产品的适应性;包装材料与成型和密封过程的适应性;包装材料与灭菌过程的适应性;包装材料所能提供的物理、化学和微生物屏障保护;包装材料与使用者使用时的要求(如无菌开启)的适应性;包装材料与标签系统的适应性;包装材料与贮存运输过程的适应性。
5、其他研究
证明产品安全性、有效性的其他研究。

来源:嘉峪检测网


