背景
IVDR法规2022年5月26日正式实施,此前欧盟发布过2个与IVDR相关的过渡期法规,其中Regulation (EU) 2022/112中除了规定了各类器械的过渡期安排,还要求遗留器械制造商在经济运营商和器械注册、上市后监督、市场监管、警戒系统这几方面使用IVDR的要求替代IVDD中对应的要求。
过渡期中的第一个时间节点2023年5月26日即将到来,您是否按照法规要求做好准备?
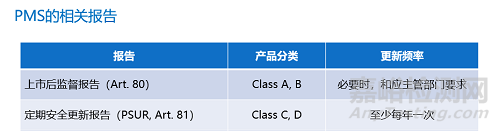
1. 定期安全更新报告 (PSUR)
众所周知,IVDR非常重视上市后监督。每个器械都要进行上市后监督并形成相应的上市后监督报告,中高风险的C & D类器械根据第81条要求需形成PSUR报告,且至少每年更新一次。
在98/79/EC中没有上市后监督的要求,企业通常按照ISO 13485的要求进行上市后监督。请制造商自查,是否已经在实施符合IVDR的要求上市后监督?器械(尤其是C和D类)是否已经生成相应的上市后报告?
针对IVD器械的PSUR指南计划2023年第3季度推出,目前IVD企业可参考MDCG 2022-21关于MDR产品的PSUR进行编写。如果您有这方面的困扰,请联系杭州翎伽。
2. UDI在标签上的应用
IVDR下获证D类器械应在今年的5月26日起在标签上使用UDI。目前遗留器械不强制要求在标签上使用UDI。