1、 前言
为了将药物推向市场,科学家们试图依赖不同类型的临床前模型来模拟人体生理结构和功能,体外评估药物的毒性和安全性。遗憾的是,传统的临床前模型(包括二维细胞模型, 三维球状细胞和各种实验动物模型)由于各自的局限性,很难真实模拟人类生理结构和功能,导致在预测药物反应上受到极大挑战。这也是为什么约90%通过临床前模型评估的药物在进入人体试验后失败的主要原因。
值得庆幸的是,科学家们开发了更具模拟人类生理环境的新一代技术:器官芯片。有了器官芯片技术,研究人员可以在更接近人体生理功能的实验模型中测试药物,可在更短的时间内获得更准确的药物反应数据,辅助筛选出更有竞争力的候选药物进入临床试验。
2010年,哈佛大学Wyss研究所Donald E. Ingber院士开发了世界上第一个成功的器官芯片:肺芯片,该研究成果发表于顶级期刊 Science 杂志【1】。随后,Donald E. Ingber院士作为学术创始人,Emulate公司成立,将该技术进行商业化推广。自成立以来,Emulate一直在引领行业发展,将器官芯片技术引入世界各地的实验室。超过100篇同行评议的学术论文发表也证明了此项技术在提高对人类健康和疾病的理解方面的重要价值。
本篇将为您系统性介绍器官芯片技术的基本原理和应用价值,尤其是如何利用器官芯片技术改善疾病研究和药物开发全流程以提高效率,并推动更多拯救生命的治疗方法的开发。阅读后,您将更好地了解药物开发中最普遍的挑战,以及什么是器官芯片,它们能做什么,以及它们可能如何能帮助您解决目前研究中遇到的障碍。
Survey of 125 scientists conducted by the Linus Group on behalf of Emulate (2021)
2、传统实验模型的局限性
为了开发药物,科学家们通常依靠小鼠、狗和非人灵长类动物 (non-human primates, NHP) 以及二维细胞系或者三维球状细胞等实验模型来预测人类反应。然而,这些传统的实验模型都有各自的特点和局限性,一定程度上阻碍药物开发:
2.1 传统实验动物模型的挑战
1. 冗长的建模和实验周期:动物实验需要很长的构建周期,通常需要3-6个月之久,并且需要大量的伦理审查和监管监督。此外每种动物模型都需要专业化的场地和技术人员进行饲养和维护,会进一步增加实验成本和时间。
2. 缺乏可重复性:无论科学家们采取何种措施使动物模型实验标准化,但每只实验动物都是独一无二的,极易受到科学家无法预料的因素影响,从而影响研究结果。事实上,Amgen公司的一项研究表明,在其研发管线中,只有约10%的动物实验可以被内部研究小组复制【2】。此外,不同科学家处理实验动物的方式差异等因素也会影响动物在实验中的反应方式。这使得可重复性这一关键指标在实验动物模型中难以有效维持。
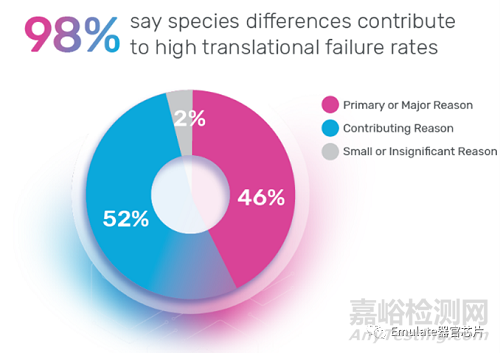
3. 物种转换问题:尽管科学家们已经努力使动物模型人性化,但物种的固有差异将永远是预测人类反应的一个限制性因素。事实上,98%的科学家都认为物种差异导致了高转化失败率【3】。考虑到目前各大药企的药物开发管线更多转向生物制品、免疫细胞疗法和其他人类特定的治疗方法,物种差异带来的挑战会越来越大。
4. 采购实验动物的困难:由于非人灵长类动物在生理、认知能力、神经解剖学、社会复杂性、繁殖和发育等方面与人类具有高度相似性。与人类的遗传物质有75%~98.5%的同源性,这种同源性在基础和转化生物医学研究中发挥着重要的作用,它们的需求量一直很大。然而,非人灵长类动物进口持续短缺,导致不仅价格飙升,而且购买十分紧俏,多次面临诸如“一猴难求”的局面。造成这种情况的原因有很多,从监管,到对繁育饲养行为的打击,再到新冠肺炎疫情期间的残余影响,但目前来看,实验动物的短缺似乎不会很快消失。
2.2 传统体外细胞模型的局限性
1. 永生化细胞系的生理相关性有限:科学家们经常依赖永生细胞系,因为它们容易获得,并且能够在实验室条件下存活并持续增殖,采购和维持的难度较低。然而,由于遗传操作而获得永生化特征的这些细胞系,其生理结构和细胞行为已经与原代人类细胞差异较大,从而导致对疾病和药物效果的理解可能会带来巨大差异。
2. 缺乏特定器官微环境:在人类体内,细胞的功能在很大程度上受到其特异性的器官环境影响,包括细胞外基质(ECM)、机械力和液体流动等因素。然而,传统的2D细胞系往往为单层细胞培养,缺乏各种细胞外基质,3D球状细胞虽然已经引入了细胞外基质,并且细胞类型也已经有进一步提升。但是它们仍然都培养在静止的体系中,意味着缺乏液体流动和物理机械力。而我们人体处于动态的环境,尤其是如我们的肺部需要有节律的呼吸运动,我们的肠道也一直在经受液体的流动和蠕动,因此,缺乏这些器官特异性的动态微环境,很难真实模拟人体生理结构和功能。
3. 缺乏体内的复杂性:在人体中,细胞相互之间存在持续不断的交互,是器官行使正常功能所不可或缺的。然而,传统2D细胞系往往只包括单一的细胞类型,导致它们对药物的反应方式不能反映体内的功能。传统的3D球状细胞在一定程度上提升了细胞之间的类型和交互复杂性,但是仍然存在一些短板,比如球体中央的细胞大部分经受缺氧环境,甚至中间的细胞已经死亡,细胞交互实际会产生问题。此外人体器官大多数伴随着各种共生微生物菌群,以及各种血管内的免疫细胞,而传统模型难以有效引入这些复杂度。
4. 缺乏血管系统:人体每一个器官几乎都需要血管系统来维持营养和正常的代谢,因此,非常有必要在体外模型中引入血管系统。但传统2D或者3D类器官球难以构建具备生理功能的血管系统,使得组织与血液系统的的交互,代谢物的有效排出都受到挑战。
5 药物灌注困难:传统静态培养的3D类器官球体中央致密,细胞高度缺氧,导致药物难以渗透到球体中央的细胞,带来模型对药物的反应难以真实呈现。加之本身缺乏血管系统,进一步阻碍了药物通过血管系统递送的可能性。
6 培养的标准化和可重复性:传统静态培养的3D类器官球模型在制备时,类器官球在培养环境中处于无序控制状态,导致培养出的类器官球体大小不一,均匀度差,同一个孔中的不同类器官球的形态都千差万别。加上缺乏有效的和标准的培养方案,同时由于不同实验室之间实验人员的差异,培养所用材料和方案的差异,导致传统3D静态类器官球模型的重复性较差。
Survey of 125 scientists conducted by the Linus Group on behalf of Emulate (2021)
值得庆幸的是,上述提到的这些挑战可以通过最新的器官技术来克服!
3、器官芯片技术基本概念、工作原理和价值
3.1 器官芯片技术概念和工作原理
器官芯片技术使研究人员能够利用活细胞和器官特异性动态微环境在体外创建一个器官的功能单元,为了解人类生物学的内部机理提供了一个模型基础。器官芯片是一种微流控的小型化灵活装置,其通常包含两个上下平行的通道。不同类型的人类相关细胞均可接种到这些通道中,包括原始细胞、iPSCs、类器官球和免疫细胞。上下通道被一层薄薄的多孔膜隔开,使其形成了一个组织与血管的界面,更好地用于细胞与细胞之间的交互。膜上包被有组织特定的细胞外基质,有助于进一步促使对应组织的成熟,形成高度与人类生理结构相似的组织界面。
器官芯片的一个重要指标和关键特征为,研究人员可以很容易地控制和微调细胞所经历的机械力,为组织在体外施加器官特异性的动态微环境。当器官芯片被置于液体流动和循环机械应力作用下时,细胞会经历类似于它们在体内的机械环境,如肠道的蠕动、肺部的呼吸和血管中的血液流动。器官芯片还能给予更复杂的结构特征,包括多细胞的复杂性、细胞与细胞之间的相互作用、组织特定的ECM和机械力,造就了器官芯片的独特优势。相比于传统细胞培养方法,器官芯片无论在结构、形态、基因表达谱还是在体外对应器官所呈现出的功能,都与人类更为接近。
器官芯片的示意图。器官芯片由两个平行的微流体通道组成,分为上层通道(1)和下层通道(2)。上皮细胞(2)或组织的实质细胞通常接种于上层通道,而下层通道往往接种血管内皮细胞(5)以形成管腔状的血管系统。上下两个通道中间由一张多孔柔性膜(4)隔开,既保证细胞的相互独立,又可使上下通道间的物质和信号交互,以及观测细胞迁移成为可能。微流体通道旁边的真空腔(3)提供了可调节的机械拉伸,更好的模拟器官运动(如肺部呼吸和肠道蠕动)。
3.2 器官芯片在药物开发中的价值
究竟器官芯片如何在药物开发工作流程中的发挥效用,它们如何提高你的临床成功率?当我们审视器官芯片的应用时,我们看到器官芯片对于药物开发管线的全流程都有益处。
一、早期发现:在药物发现的早期阶段,器官芯片可用于开发具有更接近人类基因表达和生理结构和功能的疾病模型,以确定和验证药物反应。器官芯片已被用于生成多个器官和疾病的人类相关模型,包括骨癌转移、细菌性阴道炎、环境性肠功能紊乱和COVID-19新冠肺炎等。这些模型使研究人员能够更好地了解潜在的疾病机制并开发更有竞争力的治疗方法。
二、先导物优化:在先导物优化阶段,器官芯片提供与人类相关的反应数据,对显示出最有效和最小毒性的候选先导物进行排序和优化。通过将器官芯片研究纳入药物开发的这一阶段,在人体器官芯片中产生毒性信号的化合物可以在早期体内研究中被取消优先级,尽早淘汰,从而减少动物试验,确保推动更安全的候选药物进入到后续开发流程。
三、临床前评估:在临床前安全评估阶段,器官芯片可以作为筛选工具来预测毒性的各种机制【4】。在这个阶段,它们还可以用来评估在临床前动物研究中可能观察到的毒性与人类的相关性【5】。器官芯片在这一阶段特别有利于评估越来越针对人类的新型药物,如生物制剂和免疫疗法。
四、临床试验:最后,器官芯片甚至可以对药物开发的临床试验阶段受益。对于在临床上产生意料之外的毒性信号的候选药物,器官芯片可以用来进行后续回溯性研究,以评估毒性机制,研究人员可以利用这些信息来指导备用候选药物的优先次序。
器官芯片用户案例:Emulate公司的研究人员与Janssen公司合作,通过在人类肝脏芯片上测试Atabecestat的肝脏毒性,该化合物是Janssen公司开发的BACE抑制剂,在临床试验中引起药物性肝损伤(DILI)。通过这项研究,他们确认了该化合物的肝脏毒性,确定了与治疗相关的机制和损伤生物标志物,并确认其作用机制是氧化应激引发炎症体反应。最终,这些结果能够帮助Janssen公司筛选更安全的备用化合物。
如您所见,器官芯片可以对药物开发的全流程都有益处。下一节将进一步讨论器官芯片系统丰富的实验方式及丰富应用。
4、器官芯片丰富的实验分析方式
每个器官芯片使研究人员能够收集和分析多样的数据。并且与传统细胞培养或临床中使用的终点检测相互兼容。
一、流出物分析:单向的流路设计,使得研究人员能够对每个细胞通道的流出物进行独立采样。对流出物进行定性或者定量分析,可获得功能相关的数据,如组织健康和损伤的功能生物标志物、表观渗透率(Papp)、细胞因子释放、代谢物和外泌体分泌等。
二、成像分析:这也是器官芯片平台最重要的分析手段。研究人员能够通过各种实验室成像设备评估细胞形态、标志物表达和细胞迁移等行为。器官芯片可进行原位免疫荧光,无需繁琐的切片制片过程,可直接将荧光抗体和标记物在芯片中与细胞孵育,节省大量的实验周期和资源投入。与目前各种实验室主流成像技术相兼容,包括相差显微镜、宽视场荧光、共聚焦、多光子和扫描电子显微镜。还可以进行高内涵成像,捕捉整个芯片通道的培养区域,结合AI智能分析芯片中特定细胞的表达特征和行为特征,并进行海量数据的定量分析,做到无偏好性的数据输出。
三、组学分析:组学分析手段可解析器官芯片与人体组织的相似性,或健康和病变组织之间的遗传差异,使研究人员能够确定相关的疾病分子机制,阐明其下游信号通路和主要调控因子。目前已经有成熟的转录组、基因组、单细胞组学以及蛋白组学等分析方案可供参考。
器官芯片的数据读取形式丰富多样,可更好地了解人类的生理和疾病机制。通过详尽的终点分析,Emulate可以更好地指导研究人员进行整个器官芯片的分析。
5、器官芯片应用场景
本节我们着重展示器官芯片为人类疾病机制解析和助力候选药物开发的几种方式。
5.1 细胞与基因治疗
基因疗法在治疗遗传性和获得性遗传疾病方面有着巨大的前景,但开发这些疗法的进展仍然缓慢。以基于腺相关病毒(Adeno-Associated Virus, AAV)的基因疗法为例:虽然到目前为止已经有超过136项基于AAV的疗法的临床试验,但目前只有两种被批准上市。此外,由于传统的临床前实验模型无法准确预测毒性,这些试验中有35%出现了严重的不良安全事件。
幸运的是,我们可以基于肝脏器官芯片芯片开发AAV转导应用。研究人员可以在与人类高度相似的肝脏器官芯片中快速迭代AAV设计,在临床试验前加速载体优化筛选。用户可以在上皮通道中施加待测的AAV载体,可持续监测其转导效率和毒性信号,使研究人员能够以时间和剂量依赖的方式评估转导和毒性反应。转导效率可以通过GFP在肝细胞中的表达进行量化,而AAV载体的潜在毒性可以通过白蛋白分泌和ALT释放水平等功能性生物标志物进行测量。
AAV转导效率只是基因治疗中器官芯片可以应用的一个领域。除了改善基于AAV的疗法的开发外,这一工作流程还可适用于评估AAV以外的载体,包括病毒和非病毒载体。这项技术的灵活性和敏捷性可缩短为患者提供有效和安全的基因疗法开发周期。通过让研究人员在短短几周内产生与人类相关的数据(而在非人类灵长类动物身上则需要几个月),器官芯片可以促进载体设计的快速迭代,以确保最有前景的候选载体进入临床试验。
图注:在血友病研究中,AAV6是治疗性研究的主要载体之一。为了评估Emulate肝脏芯片在预测AAV转导和肝脏毒性风险方面的作用,用编码绿色荧光蛋白(GFP)的AAV6载体处理肝脏芯片。AAV6表现出时间和浓度依赖性的转导表型,而肝实质细胞和肝窦内皮细胞保持健康的形态,没有毒性信号存在。
5.2 免疫与炎症
炎症在许多疾病中起着作用,慢性炎症性疾病在全世界造成了五分之三的死亡【6】。然而,由于在体外建立复杂的免疫反应模型难度极大,加上常用的动物模型与人类免疫系统的差异巨大,我们目前对炎症的机制仍然知之甚少。
器官芯片技术可用于建立更多与人类相关的炎症模型,使研究人员能够将体内看到的细胞多样性纳入到这种体外模型中。器官芯片模型的灵活性使研究人员能够精确控制和研究炎症过程中各种因素的单独或联合贡献,包括常驻和循环免疫细胞、炎症细胞因子、细胞-细胞相互作用和组织相关的机械力,更好地了解疾病病理和药物效应。
以炎症性肠病(Inflammatory Bowel Disease, IBD)为例。结肠器官芯片可以准确模拟失调的免疫细胞招募,这是IBD发病机制的主要因素。当免疫细胞在促炎症因子的刺激下流经芯片的血管通道时,它们经历了免疫细胞招募的整个过程:从附着到迁移,再到下游效应器功能和屏障损伤。这是迄今为止唯一一个以组织和炎症特异性方式捕捉这一完整过程的模型,使我们能够更完整地了解IBD的发病机制。该模型评估了四种具有不同作用机制的临床相关IBD治疗药物,表明器官芯片可用于评估药物疗效和对候选药物进行排序。
图注:复杂的免疫反应,包括免疫细胞的招募,都可以被模拟出来。这里显示的是PBMC(红色CellTracker 预染)免疫细胞从血管通道招募到上皮通道的过程,IBD发病机制的关键步骤。
5.3 毒理研究
如何评估药物对人体的毒性是目前生物制药公司在开发安全有效药物时面临的巨大挑战。大约30%的药物在临床试验中因毒性而失败--尽管已经通过了动物的临床前安全筛选【7】。换言之,传统的模型缺乏预测毒性的价值,无法高效地将有竞争力的候选药物推向临床。
器官芯片使研究人员能够在药物开发的早期预测药物对人类的反应,从而有信心将其转化为到临床试验阶段。为了衡量器官芯片能在多大程度上改善病人的安全,研究人员根据IQ MPS联盟(国际药品开发创新和质量联盟的一个附属机构)规定的指南标准,对Emulate人体肝芯片进行了鉴定。该研究表明,肝脏芯片能够正确识别87%的导致患者药物性肝损伤(Drug-Induced Liver Injury, DILI)的测试药物,而这些药物,之前都能顺利地通过了动物评估,但在临床试验中因为毒性造成受试者的死亡而终止。同时,Emulate人类肝脏芯片没有错误地识别任何无毒的药物,特异性达到100%,这种完美的特异性为器官芯片在毒理学筛选工作流程中的应用奠定基础【4】。
为了证明在临床前评估中使用器官芯片如何能改善临床试验的结果,请看如下的这个使用案例:TAK-875是一个候选药物,它由于DILI而在III期试验中被中止了。当在肝脏芯片上对该化合物进行回顾性研究时,结果显示,长期接触该化合物会导致线粒体功能障碍、氧化应激、脂滴形成和先天免疫反应,这些都是易感患者DILI的预兆【8】。如果在临床试验之前进行肝脏芯片研究,研究人员可以更早地发现人类特有的毒性问题,取消TAK-875作为候选药物的优先级,并将更安全的候选药物向前推进。
图注:识别特异性DILI的风险。每天用TAK-875处理人类肝脏芯片,剂量相当于人类的Cmax(10μM),以确定它们是否能检测DILI。对 MRP2底物CDFDA(绿色)的胆汁外流进行共聚焦显微镜分析显示,TAK-875导致MRP2活性的剂量依赖性下降。同时,通过测量TMRM的剂量相关和时间依赖的重新分布、脂滴积累和活性氧(ROS)的形成,证实TAK-875的治疗对线粒体膜电位有影响。这些结果与TAK-875治疗的临床结果一致,表明肝脏器官芯片可用于评估特异性DILI。
6、用户反馈结果:器官芯片优于传统的临床前模型
器官芯片是如此强大的技术,可以帮助科学家在整个药物研发过程中更早地预测药物对人体的反应。调查中,97%的器官芯片用户同意,器官芯片比传统的体外模型更具预测性。此外,更令人惊讶的发现是,70%器官芯片用户认为该技术比体内模型更具预测性,另有21%的用户认为该技术具有类似的预测性【3】。这些调查结果直接说明了采用器官芯片技术可以对延误研究项目产生影响。
7、总结
正如本文所讨论的,器官芯片技术可以帮助研究人员克服与传统体外和体内模型相关的一些挑战。下表总结了一些最常见的挑战以及器官芯片可以带来什么样的帮助。

为了使广大科研工作者能快速掌握器官芯片技术,Emulate开发了商业化的器官芯片系统Human Emulation System ®。加上积累的超过75种的标准化解决方案,科研人员使用该系统将非常容易在体外构建多种器官模型,为各自的研究添砖加瓦。
参考文献
1. Huh D, Matthews BD, Mammoto A, Montoya-Zavala M, Hsin HY, Ingber DE. Reconstituting organ-level lung functions on a chip. Science. 2010 Jun 25;328(5986):1662-8. https://doi: 10.1126/science.1188302.
2. Begley, C. G., & Ellis, L. M. (2012, March 28). Raise standards for preclinical cancer research - Nature. Nature. https://doi.org/10.1038/483531a
3. Survey of 125 scientists conducted by the Linus Group on behalf of Emulate (2021)
4. Ewart, L., Apostolou, A., Briggs, S. A., Carman, C. V., Chaff, J. T., Heng, A. R., Jadalannagari, S., Janardhanan, J., Jang, K. J., Joshipura, S. R., Kadam, M. M., Kanellias, M., Kujala, V. J., Kulkarni, G., Le, C. Y., Lucchesi, C., Manatakis, D. V., Maniar, K. K., Quinn, M. E., . . . Levner, D. (2022, December 6). Performance assessment and economic analysis of a human Liver-Chip for predictive toxicology - Communications Medicine. Nature. https://doi.org/10.1038/s43856-022-00209-1
5. Jang, Kyung-Jin, et al. “Reproducing Human and Cross-Species Drug Toxicities Using a Liver-Chip.” Science Translational Medicine, vol. 11, no. 517, 6 Nov. 2019, p. eaax5516, stm.sciencemag.org/content/scitransmed/11/517/eaax5516.full.pdf, https://doi.org/10.1126/scitranslmed.aax5516.
6. Pahwa, R., Goyal, A., & Jialal, I. (2022, August 8). Chronic Inflammation - StatPearls - NCBI Bookshelf. Chronic Inflammation - StatPearls - NCBI Bookshelf. https://www.ncbi.nlm.nih.gov/books/NBK493173/#_article-19530
7. The NIH microphysiological systems program: developing in vitro tools for safety and efficacy in drug development - PubMed. (2019, October 1). PubMed. https://doi.org/10.1016/j.coph.2019.09.007
8. Liver Safety of Fasiglifam (TAK-875) in Patients with Type 2 Diabetes: Review of the Global Clinical Trial Experience - PubMed. (2018, June 1). PubMed. https://doi.org/10.1007/s40264-018-0642-6