摘 要
人工智能/ 机器学习(AI/ML)用于医药产品临床前、临床开发、生产、上市后监测,有望对医药产品开发和使用带来深刻影响,同时对制药行业和药品监管带来机遇和挑战。为促进相关领域的监管工作,2023 年5 月FDA 发布《人工智能和机器学习用于药品与生物制品开发的讨论文件》。本文通过对讨论文件的探讨,概述了 AI/ML 在药品开发过程中的运用现状和潜在用途,以及FDA 运用AI/ML 的经验,并介绍了在药品开发过程中运用AI/ML 的考量因素,旨在推动创新技术在医药产品领域的运用,挖掘更多潜在效能。
The application of artificial intelligence/machine learning (AI/ML) in preclinical, clinical development, manufacturing,and post-marketing surveillance of pharmaceutical products and devices is expected to have a profound impact on drug product development and use, while also posing challenges to the pharmaceutical industry and regulatory bodies. In order to promote regulatory work in related areas, the FDA released the Using Artificial Intelligence & Machine Learning in the Development of Drug & Biological Products: Discussion Paper and Request for Feedback in May 2023. This paper provides an overview of the current status and potential uses of AI/ML in drug development from the perspective of the discussion paper.It also highlights the experience of FDA in using AI/ML and introduces the considerations for using AI/ML in drug development,aiming to promote the application of innovative technologies in the pharmaceutical products field and explore its potential efficacy further.
关键词
人工智能;机器学习;医药产品;开发
artificial intelligence; machine learning; pharmaceutical product; development
为进一步推动相关领域的监管工作,2023 年5 月,美国食品药品监督管理局(FDA)药品审评与研究中心(CDER)、生物制品审评与研究中心(CBER)、器械与放射卫生中心(CDRH)数字医疗卓越中心(DHCoE)联合发布《人工智能和机器学习用于药品与生物制品开发的讨论文件》(Using Artificial Intelligence & Machine Learning in the Development of Drug & Biological Products :Discussion Paper and Request for Feedback)[1],就在药品、医疗器械(包括药械组合产品)开发中运用人工智能和机器学习向利益攸关方征询建议、意见。
数据采集和生成工具领域快速发展的技术创新,加上性能强大的信息管理、交换系统和先进的计算能力,有望改变药品开发和使用方式[2]。这一不断发展的创新生态系统,对制药行业和药品监管带来了独特的机遇和挑战,如何抓住机遇、充分发挥创新潜力,更好地服务公众,成为药品监管机构、制药行业与利益攸关方共同面临的问题。
在整个药品开发过程中,如何充分利用人工智能和机器学习等创新技术,需要药品监管机构、制药行业与利益攸关方达成共识,建立有效的交流、对话、协作机制。根据国际医疗器械监管机构论坛(IMDRF)人工智能医疗器械工作组(AIMD WG)N67《 机器学习赋能医疗器械:关键术语和定义》(Machine Learning-enabled Medical Devices: Key Terms and Definitions),人工智能(artificial intelligence,AI)属于计算机科学、统计学和工程学的一个分支,使用算法或模型来执行任务与机器学习等,做出决策,开展预测[3]。机器学习(machine learning,ML)被认为是AI 的一个子集,允许ML 算法通过对数据的分析来开发ML 模型,无需编程经验。AI/ML 涉及药品开发、临床试验、生产和上市后安全监测等阶段[3]。
《机器学习赋能医疗器械:关键术语和定义》中概述的多项AI/ML 科学与监管科学原则,可能适用于所有医药产品,包括与药品一同使用的医疗器械的开发(包括但不限于组合产品、配套器械和补充器械)。讨论文件中涉及的医疗器械,包括帮助识别确认药品不良反应、帮助定量给药的医疗器械。
讨论文件旨在与包括学术团体、研究机构和技术开发机构在内的利益攸关方,促进相互学习和讨论。了解认识一些涉及相关技术运用的初步想法和考量因素,熟悉FDA 现行决策、举措、规范和适用法规,对新进入药品开发和人体受试者研究领域的机构尤其有益。
1、 讨论文件的主题介绍
讨论文件涉及AI/ML 现状和潜在用途前景、AI/ML 运用的考量因素、后续步骤和利益攸关方参与3 个主题,分述如下。
1.1 AI/ML 现状和潜在运用前景
FDA 认识到AI/ML 具备增强药品开发的潜力,包括有助于为患者更快提供安全有效的药品;提供更广泛的药品可及途径,从而提高健康公平性;提高制药质量;提高药品安全性;开发新药和新药物类别,以及个体化疗法。讨论文件提供AI/ML 的用例,突出AI/ML 在整个药品开发过程中的潜在影响,同时概述FDA 对药品开发中采用AI/ML 的经验,列举可能适用或不适用于FDA 的用例,促进共同交流,确定对未来监管清晰度可能有所帮助的领域。
1.2 AI/ML 运用的考量因素
FDA 认识到AI/ML 等新兴创新技术的潜在问题和风险,并将分享初步考量,征询关于如何帮助确保在药品开发过程中负责任地使用AI/ML 的建议、意见。需要制定在不同应用场景中使用AI/ML 的通用原则、标准和规范,探讨在将AI/ML 用于药品开发活动时可能特别适用的原则和考量。FDA 认识到在药品开发中运用AI/ML 是多样化的,需要仔细评价,考虑具体运用环境。采用基于风险的方法来评价和管理AI/ML 的运用,助力创新,保护公众健康。
1.3 后续步骤和利益攸关方参与
FDA 重视与所有利益攸关方相互学习和接触的机会,关注建立对AI/ML 系统及其在药品开发中快速发展的潜在用途和考虑的共同理解。为了启动监管机构与利益攸关方的广泛对话,关注相关议题的各方需要各抒己见,积极参与。
2、 AI/ML 在药品开发过程中的运用现状和潜在用途
药品开发过程是一个连续的迭代活动,并不具备严格的线性特征,但出于简单起见,从药物发现和临床研究到上市后安全监测和先进制药等药品开发的不同阶段来描述AI/ML 用途。AI/ML还可用于支持药品开发的真实世界数据和来自数字医疗技术数据处理。在不同的药品开发用例中,AI/ML 也同样面临挑战和考量。
2.1 药物发现
早期药物发现是AI/ML 受到关注和被采用的主要领域之一。AI/ML 已用于药物靶点识别、选择和优先级确定,以及药物发现的化合物筛选和药物设计中。
2.1.1 药物靶点识别、选择和优先级确定
药品开发早期阶段,通常依赖于初步确定候选药物所需的适用生物靶点。以此作为起点,可以利用AI/ML 来分析和综合来自现有科学研究、出版物和其他数据来源的大量信息,识别确定生物靶点和阐明疾病关系的过程。来自健康人群和特定疾病患者的可用基因组、转录组、蛋白质组和其他数据源的增长,为生物靶点的选择提供重要机会。这些数据集通常是复杂的,来源各异,可以很好地借助AI/ML 方法[4]。
在现有验证数据的基础上,AI/ML 可用于挖掘和分析这些大型多组学和其他数据集,提供有关生物靶点的潜在结构和功能,预测相关靶点在疾病路径中的作用[5-6]。尽管在早期靶点识别和优先排序中采用AI/ML 有助于提高药品开发的效率和效果,但需要通过后续研究验证生物靶点在相关疾病中的作用[4]。
2.1.2 化合物筛选和设计
发现具有潜力的候选药物,通常需要对化合物库进行大量的虚拟或实验筛选,然后进一步完善候选化合物对生物靶点的特异性和选择性。在化合物筛选领域,AI/ML 的潜在用途包括预测化合物化学性质与生物活性,并根据化合物对靶点特异性和亲和力预测潜在疗效与不良事件[4,7-8]。
AI/ML 也可用于进一步阐明药物- 靶点间的相互作用,提供可能与相同靶点相互作用的药物类别预测或类似的作用机制,根据分子已知特征预测分子毒性,指导药物改变用途(drug repurposing)。使越来越多来自各种来源(例如,电子病历、临床试验登记)获得的适用的真实世界数据(来自电子病历、登记和数字医疗技术)受益,利用AI/ML 的药物改变用途,有助于确定先前未知的药物对疾病路径的影响[9]。
此外,AI/ML 还可以加速从头药物设计(de novo drugdesign)[10]。例如,AI/ML 可用于帮助预测靶标蛋白的三维结构,为化学合成和候选药对靶标的潜在影响提供信息,包括预测亲和力和潜在毒性[11-13]。值得注意的是,在3D 结构预测中需要慎重使用AI/ML,原因在于很多针对药用开发的蛋白质经过密码子优化(伴以多个同义突变),对蛋白质结构的影响仍处于积极探索中[5,11]。
2.2 非临床研究
非临床研究包括体外和体内研究,旨在进一步推动潜在的治疗方法进入人体临床研究开发。新药开发过程中的非临床研究,可以在开发的各个阶段进行:在临床研究之前,与临床开发同时进行,甚至在获批上市后也可以开展。非临床研究包括采用实验动物开展的药代动力学、药效学和毒理学研究;在动物模型中开展的体外和体内机制探索研究;器官芯片和多器官芯片系统;细胞检测平台数据可利用AI/ML(例如,计算建模和模拟技术)来评估毒性、探索机制模型和开发体内预测模型[14-18]。
药代动力学(PK)用于描述药物吸收、分布、代谢和排泄的时间过程。药效学(PD)探讨人体对药物的生物响应。将PK 和PD 整合到一个模型中,该模型可以描述当使用某种剂量或给药方案时,药物效果将如何随时间变化。药品开发中采用PK/PD 模型已有数十年历史,包括非临床和临床阶段[19]。随着计算工具、技术以及建模平台的可用性不断进展,运用基于生理的药代动力学(PBPK)和药代动力学/ 药效学(PBPK-PD)建模也随之增加[20]。目前正在探索PK/PD 建模采用更多新的AI/ML 算法,包括人工神经网络模型和树状模型。递归神经网络是一种常用于分析时间序列数据的ML 算法,可用于高度复杂的PK/PD 数据分析领域,以补充传统的PK/PD 模型,并有可能提高非临床和临床应用的准确性[21]。
2.3 临床研究
临床研究通常包括Ⅰ ~ Ⅲ期临床试验,用于评价在研药品安全性和有效性。简化和推进临床研究成为AI/ML 在药品开发中最重要的应用领域之一。例如,采用AI/ML 分析来自干预性研究(也被称为临床试验)和非干预性研究(也被称为观察性研究)的大量数据,用于判断药品安全性和有效性。AI/ML 有可能为非传统试验的设计和效率提供参考,例如分散式临床试验。此外,AI/ML 还可用于从电子病历、医保理赔或其他数据源提取真实世界数据的试验;用于分析、解读来自数字医疗技术的数据;用于改善临床试验运行,帮助锁定、招募参与临床试验的目标患者人群,提高临床试验运行效率。
2.3.1 患者招募
AI/ML 越来越多用于参与者有可能从中受益的新药临床试验。这类临床试验采用AI/ML 挖掘大量数据,例如来自临床试验数据库、试验公告、社交媒体、医学文献、临床试验登记及电子病历的结构化与非结构化数据。AI/ML也可用于将个人与试验匹配[22]。尽管这些算法是在大量的患者数据和过去试验的入选标准上训练出来的,但重要的是要确保充分代表可能的人群。可能使用该药物人群的代表性(例如,性别、种族等),建立和采用匹配算法,确认在招募过程中实现了公平入组。在未来,这些技术如果得到适当的验证,能够继续在匹配个人与研究性治疗方面发挥越来越大的作用。
2.3.2 试验参与者选择和分层
对于旨在证明药品和生物制品有效性的临床研究,采用富集策略可以帮助选择试验参与者[23]。研究者已探索将AI/ML 作为临床研究的一部分,根据基线特征(例如,人口统计学信息、临床数据、生命体征、实验室、医学影像数据和基因组学数据)预测个体参与者的临床结局[24-28]。这种预测模型可用于临床试验患者富集(例如,识别确认高风险参与者或更有可能对相关治疗产生响应的参与者)。AI/ML 算法用于随机化之前的患者评估和选择,可能会减少变异性并提高研发效能[29]。
除了用于富集策略外,如果AI/ML 模型可以在实施研究性治疗之前预测严重不良事件的概率,还可通过预测模型将参与者分层。根据对这些严重不良事件的预测风险,可将参与者分层为不同小组,然后予以相应监测,或根据所预测的不良事件严重程度予以剔除。
2.3.3 剂量/ 给药方案优化
AI/ML 可用于描述和预测给药后的PK 曲线。还可在考虑存在混杂因素情况下,用于研究药量与响应之间的关系。这类模型可用于优化研究的剂量/ 给药方案选择。包括帮助数据数量有限的特殊人群, 例如, 针对罕见病患者、儿童和孕妇进行剂量优化[30-31]。
2.3.4 参与临床试验的患者依从性
在临床试验期间,AI/ML 可以通过工具来监测和改善患者依从性。例如,通过智能手机提醒,或通过智能药盒和目视确认工具实现电子跟踪用药,以及电子追踪错过的临床诊视,从而触发不依从警报[32]。在临床研究中,AI/ML 用于提高用药依从性的实例包括数字生物标志物的应用,例如面部、声音表达,以远程方式监测依从性。
2.3.5 患者保持
AI/ML 有可能通过启用相关工具,例如AI 聊天机器人、语音辅助和智能搜索,改善参与者获取相关的试验信息。AI/ML 也可用于减少参与者负担。通过使用被动数据采集技术,以及从临床实践或研究中产生的可用数据中提取更多信息[33]。此外,来自数字医疗技术和其他系统的数据可用于建立患者档案,以潜在地预测退出和不良事件,确保参与者的保留。
2.3.6 临床试验场所选择
可利用AI/ML 优化临床试验运行,帮助确定哪些场所具有成功试验的最大潜力,帮助相关场所确定流程方面的差距。例如,使用相关算法来评价试验场所的表现,并根据相关场所的其他试验数据,帮助确定哪些场所落后于项目进度的风险可能较高。
2.3.7 临床试验数据采集、管理和分析
(1)数据采集。数字医疗产品,例如与无线、智能手机连接的产品、可穿戴设备、植入式器械和摄入式器械,正越来越多地被用于临床试验,用于采集客观、可量化、纵向、连续的生理数据。此外,很多数字医疗产品采用AI/ML,作为数字医疗产品内嵌算法,用于从数字医疗产品采集生成的数据,用于预测慢性疾病病况及其对治疗的响应[34],或识别确定潜在病症的新特征[35]。可采用AI/ML 来分析应用这些产品对临床受试者开展的持续监测所产生的大量和多样化数据。包括采用AI/ML 来帮助评估通过多个数字医疗产品采集的多个具体测量值组合而成的多模态数据和综合测量值[36]。
(2)数据管理。AI/ML 可用于一系列的数据清理和整理,包括重复参与者的检测和缺失数据值估算[37],以及协调不同药品开发项目受控术语的能力。在药品开发项目中统一受控术语(controlled terminology),受控术语是与临床数据交换标准协会(Clinical Data Interchange Standards Consortium ,CDISC) 定义的数据集中的数据项一起使用的代码列表和有效值的集合。受控术语提供在符合CDISC 的数据集中提交给FDA和PMDA 所需的值[38]。
AI/ML 的使用也可以通过使用监督和无监督学习来大大加强数据整合工作,和无监督学习来帮助整合以各种格式提交的数据并进行数据质量评估。此外,AI/ML 还可用于通过对个人身份信息的屏蔽和去标识来进行数据整理。信息,创建元数据,以及搜索和检索存储数据。这些应用有可能提高数据的准确性,并提高为分析准备数据的速度。
(3)数据分析。AI/ML 已用于分析从电子病历、医保理赔和疾病登记处等来源提取的大量多样而复杂的真实世界数据。此外,目前正在积极探索在预测性建模和反事实模拟中使用AI/ML,为临床试验设计提供信息。例如,虚拟临床试验(in-silico clinicaltrial)利用计算建模和模拟来评估候选药物,采用虚拟队列模拟参与者,能够代表所需参与者群体的真实变异性[39]。AI/ML 能够在这些情况下,帮助评估大量的反事实模拟,在开展人体试验前预测试验结果。
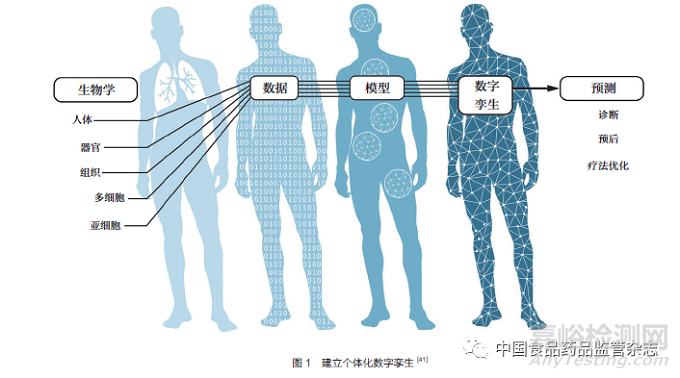
在更具个体化的层面上,AI/ML 也可用于患者的数字孪生。数字孪生属于新兴的方法,有可能用于临床研究。为了创建患者的数字孪生,AI/ML 可以用来构建个体的计算机表示或复制品,这些表示或复制品可以随着时间的推移动态反映分子和生理状态(图1)[40-42]。与接受在研药品治疗的临床试验参与者相比,数字孪生有望提供一份全面、纵向和计算生成的临床记录,描述如果特定参与者接受安慰剂治疗时可能会发生的情况。
(4)临床终点评价。临床终点评价是评估临床试验中医疗干预措施的安全性和有效性的关键所在。启用AI/ML 的算法,可以检测一组体征和症状,识别确定潜在的安全信号,帮助实时检测出存在安全问题的病例[43-44]。AI/ML 可用于协助评估临床试验期间从不同来源(例如,数字医疗产品、社交媒体)获取的结果,包括由大量数据组成的结果,手动审查可能不切实际。
2.4 上市后安全监测
药物警戒(PV)指与检测、评估、了解和预防不良事件或所有其他药品相关问题(包括用药差错和产品质量问题)的科学研究和活动。上市后安全监测,或获批后的药物警戒活动,包括与使用人用药品和生物制品有关的不良事件的上市后安全报告。个案安全报告(ICSR) 用于向FDA 报告不良事件的上市后报告,作为上市后安全监测中潜在药物安全问题的重要数据源。ICSR中的临床信息,包括一种或多种可疑产品,以及与产品使用相关的时间信息以及患者病史、临床过程和结局中的不良事件。完整、准确报告ICSR,对了解药物的安全性至关重要。由于ICSR 数量增加等原因,正在探索AI/ML 应用程序来帮助处理和评估监管机构内的ICSR 提交[45-46]。
2.4.1 案例处理
ICSR 处理过程中,有可能使用AI/ML 自动处理。ICSR 中不良事件数据来源的数量和复杂性都在增加,包括来自患者自我报告、临床试验、电子病历、社交媒体、电话、电子邮件、文献、患者登记、理赔数据和获批后安全研究[47]。采用AI/ML 检测源文件的信息,有助于识别确认提交给ICSR 的不良事件。已开始探索采用AI/ML 从文献中检测和评估事件关联,筛选社交媒体中报道的不良事件[48-51]。
在从数据源中识别、确认不良事件后,AI/ML 可用于案例有效性、案例优先级、重复案例检查、编码和质量控制。使用AI/ML 可以帮助识别一个案例是否为有效案例,这包括确定一个案例是否包含最低的报告要求,例如可识别的患者、可疑药品或生物制品、不良事件和可识别报告人[52-53]。在病例入组过程中,为了帮助确定病例的优先次序,AI/ML 被用来按预期性(不良事件是否已知并被收录于产品标签中)对不良事件进行分类[47,52]。正在使用AI/ML 自动进行重复检查,以确定该病例是否确实重复,属于先前已有记载病例的后续版本,还是新病例。另一个应用AI/ML 的领域是将ICSR 中记录的不良事件编码为结构化医学术语,用于质量控制[54]。
2.4.2 病例评估
不良事件案例需要经过临床评价。案例评估包括评价药物和不良事件之间的因果关系的可能性,以及评价相关案例的结局。根据因果关系评价中使用的相关特征,开发一个AI 模型;模型需经过训练、验证和测试,根据药物和不良事件之间因果关系的概率,对病例分类[55]。AI/ML 也被应用于确定ICSR 结果的严重性,用于支持案例评估,同时有助于及时提交需要快速报告的个别案例[47]。
2.4.3 病例提交
一般情况下,病例处理的最后一步是提交ICSR。AI/ML 算法已用于自动向FDA 提交ICSR 规则。ICSR 需要基于个人汇总[54]。不良事件的汇总报告一般涉及产品安全数据的汇编,按照规定的时间间隔提交。AI/ML 可以用来开发汇总报告,其中包括在一个时间段内发生的特定产品的多个不良事件,用于报告用途[56]。
2.5 先进制药
工业4.0 汇集了多项快速发展的技术,有望为制造商创造出严格合规、超级链接、数字化的生态系统和医药价值链[57]。AI/ML 是贯彻、实现工业4.0 的重要推动因素。药品开发涉及制药、加工、包装和存储药品的方法、设施和控制,需要确保药品符合安全性、有效性要求,符合鉴别特性、规格,同时符合质量和纯度特征。运用AI/ML 的先进分析技术为药品制造提供多种可能性,包括加强工艺控制,改善设备可靠性和产量,监测制药工艺中受控状态之外的早期警告或信号,检测反复出现的问题群,防止批次损失。使用AI/ML 来支持制药业,可以与其他先进制药技术(例如,过程分析技术、连续制造)一起部署,以实现预期效益。
AI/ML 也可用于通过预测产品需求、分析生产计划、估算、减轻潜在中断的影响以及优化库存,提高制药供应链的可靠性。基于AI/ML 的方法在药品生产中的应用,涵盖从设计到商业化大生产的整个药品生产周期。
2.5.1 工艺设计优化
数字孪生也可用于工艺设计优化。工艺数字孪生是物理过程的数字复制,用于更好地理解、分析、预测和优化工艺性能。对于分析以有限的开发数据为特征的制造工艺,数字孪生尤其有用。AI/ML 模型可利用产品和工艺的现有知识(例如,来自先验研究、开发计划和科学文献),更快地确定最佳工艺参数,减少设计时间和浪费。
2.5.2 先进工艺控制
制药业实施工艺控制已有数十年历史。传统的工艺控制将输入的工艺参数维持在设定点,不能同时改变多个输入参数,将输出参数维持在期望的水平,以优化工艺。另外,先进工艺控制允许对工艺进行动态控制,实现预期输出(图2)[58]。
AI/ML 技术,例如神经网络,输入实时工艺数据,可用于实现先进工艺控制。这些方法也可用于工艺控制开发,通过使用AI/ML 工具与实时传感器数据相结合,预测工艺是否处于受控状态。
传感器数据,包括与生产线的智能监控相结合的传感器数据,用于改善现有生产线的效率和产量。预期将物理、化学知识与AI/ML 技术相结合的先进工艺控制方法将被越来越多地采用,已有数家制药公司采用这种方法。在这些先进工艺控制应用中,高质量的模型输入为工艺理解和模型结构提供信息。在与数据驱动的建模相结合时,利用这些强大的输入,可推导出模型参数,提高模型稳健性。
2.5.3 智能监控和维护
制造过程可以实现自动化和实时监控,在不影响产品质量的前提下,实现更为有效的库存管理,缩短交货时间,提高产率。AI/ML 方法可用于监测设备和检测偏离正常性能、需要触发维护活动的情况,减少工艺过程中的停机时间。另一个实例是在质量控制中使用计算机可视化、图像,例如包装、标签或西林瓶图像,由AI/ML 软件分析,检测偏差,确保图像符合产品给定质量属性的要求。用AI/ML 方法增强对药品和包装的目视检查,可提高目视检查控制的准确性和效率。
2.5.4 趋势监测
AI/ML 可用于多个领域,使制药更加有效、高效,产出更快,浪费更少,在更为知情的情况下做出决策,加强质量控制。目前,工艺偏差分析主要是由质量部门员工和相关主题专家完成。AI/ML 可用于协助审查偏差报告,这些报告包含大量数据或文本,以分析与制造有关的偏差趋势,将相关问题聚类,优先考虑主动持续改进的领域。仅靠人工审查偏差趋势非常耗时,因此借助AI/ML 可以加快识别确认根本原因的过程。AI/ML 方法与工艺性能(Ppk)和工艺能力(Cpk)指标相结合,可用于主动监测生产操作趋势和失控事件,预测触发整改与预防措施有效性评价的限度。
3、 FDA 在药品开发过程中使用AI/ML 的经验
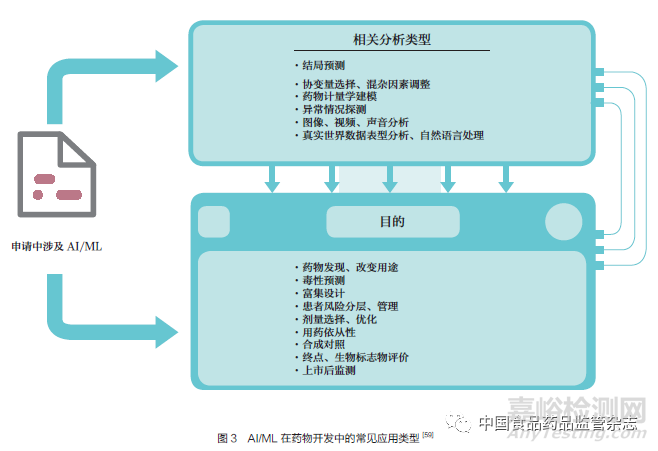
FDA 认识到在整个药品开发周期中越来越多地采用AI/ML,及其在加速开发安全、有效的药品方面的潜力。AI/ML 越来越多地被整合到FDA 积极参与的领域中,包括临床试验设计、数字医疗技术和真实世界数据分析。在过去的几年里,引用AI/ML 的申请数量迅速增长。2021 年, 涉及AI/ML 的药品和生物制品申请材料增加到100 余份[59]。这些申请跨越了一系列的治疗领域,AI/ML 在申请中的用途涵盖药品开发过程的许多不同领域,从药物发现、临床试验患者富集、终点评估、制药工艺到上市后安全监测(图3)。申请提交中涉及AI/ML 最多的是在临床开发/ 研究阶段纳入AI/ML。
FDA 一直支持创新和强有力的AI/ML 的发展, 设立CDER人工智能指导委员会(AISC),该委员会负责协调药品开发过程中运用AI/ML。CDRH 设立数字医疗卓越中心,通过推进创新方法、促进整个机构的协作,为涉及AI/ML 的药品申请提交提供咨询。FDA 正在为基于AI/ML 的器械开发制定框架,包括为嵌入AI/ML 的器械制定预先确定的变更控制计划,同时正在着手制定医疗器械开发ML 规范的依据。此外,FDA 还组织了各种研讨会,召开了患者参与咨询委员会(Patient Engagement Advisory Committee,PEAC) 会议, 讨论数字医疗技术和AI/ML 相关主题。通过与外部学术机构和临床研究机构合作,促进监管科学研究,涉及稳健性、以用户为中心的透明度、识别确认和管理,以评估新兴AI/ML 产品的安全性和有效性。
此外,CDER 还制定了新药创新科技路径(the Innovative Science and Technology Approaches for New Drugs,ISTAND)试点计划,旨在拓展药品开发工具的类型,包括利用数字医疗技术工具,纳入药物开发工具认证计划。运用AI/ML,可授予药物开发工具资质,或可用于帮助解读、分析传统药品开发工具(例如,生物标志物或临床结局评估),有可能加速新的药品开发工具评估,加强可供决策采用的证据,加快向患者提供新的治疗方法。针对模型提供信息的药品开发(model-informeddrug development,MIDD),FDA CDER 和CBER 设立MIDD试点项目,以促进开发和应用非临床和临床数据来源的基于药量的生物学和统计学模型。对于MIDD,AI/ML 有助于改善临床试验模拟、优化剂量选择或估算,或加强预测性或机制安全性评估。
在上市后安全监测领域,FDA 的哨点计划, 包括CDER的哨点系统(Sentinel System)、CBER 的生物制品有效性和安全性(Biologics Effectiveness and Safety,BEST) 系统, 以及CDRH 的国家卫生技术评估系统(National Evaluation System for health Technology,NEST),正在探索运用AI/ML 方法, 改进现有系统[60-62]。FDA在为期5 年的哨点系统战略计划中,概述了使用由先进分析支持、将理赔与电子病历数据链接的目标。哨点系统创新中心计划采用“四管齐下”的方法,通过将新兴的数据科学创新与电子病历数据用于医药产品安全监控,来实施这一计划。采取的4 项措施包括:①数据基础设施;②特征工程;③因果推理;④检测分析[63]。相关的AI/ML 应用,包括自然语言处理(natural language processing,NLP)和从非结构化电子病历临床记录中自动提取特征,用于可计算的表型,以及使用先进的统计和ML 方法从基于电子病历的变量中改进混杂调整[64-65]。
CBER 的BEST 系统旨在提供更好的数据源、方法、工具、专业知识和基础设施,以开展监测和流行病学研究。该计划的一部分是使用AI/ML 方法来分析电子病历,预测或更好地了解与使用生物制品和CBER 监管的其他产品有关的不良事件。这项工作也可以加强FDA 对采用AI/ML方法来生成关于产品疗效的真实世界证据的理解。
CDER 也在探索AI 应用,以加强对提交给FDA 不良事件报告系统(FDA Adverse Event Reporting System,FAERS)ICSR 的评估[46]。采用AI/ML 开发信息可视化平台(Information Visualization Platform ,InfoViP),用于检测重复的ICSR,按信息质量水平对ICSR 分类,推导出可视化的临床事件时间轴,用于帮助分析报告的不良事件[66-68]。已经研究了AI/ML 方法来自动识别药物产品标签中的不良事件,以支持安全审查员对ICSR 进行分流,促进识别未知或意外的安全问题[69-70]。另一个基于AI 的工具是计算机化标签评价工具(the Computerized Labeling Assessment Tool,CLAT),用于自动审查标签、标识, 例如处方信息、包装盒和容器标签等。NLP 和ML 也用于探索将FDA 不良事件报告系统 ICSR中的自由文本叙述分类为结构化的医学词典用药差错术语,以支持人类对编码质量的审查。此外,通过FDA 的质量量度报告计划(Quality Metrics Reporting Program),CDER 的新兴技术计划和CBER 的先进技术团队计划,FDA 通过让行业参与进来,获取AI/ML 在药品生产中所采用案例的反馈[71-72]。
FDA 还利用广泛机构公告(Broad Agency Announcement)等机制,面向监管机构外,公开征集解决新兴监管科学优先事项方案,包括利用外部专业知识和基础设施,对整合和评估用于药品开发中AI/ML 的方法提供深入了解。
4、 在药品开发过程中使用AI/ML 的考量因素
AI/ML 已广泛用于药品开发活动,不断发展。AI/ML 的使用有可能加速药品开发过程,使临床试验更安全、更具效率。然而,评估AI/ML 的使用是否引入了特定的风险和危害非常重要。例如,AI/ML 算法有可能放大基础数据源中存在的差错和预先存在的偏倚,当将研究结果被外推到检测环境之外时,会引起与可推广性和伦理问题的担忧。此外,可能由于固有的复杂性,AI/ML 系统可能会表现出可解释性有限,或者由于专利原因导致不完全透明。这些担忧导致了对开发可信赖的AI 标准的关注,相关标准有望解决诸如可解释性、可靠性、隐私权保护、安全性、安全保障和降低偏倚等具体特征。FDA的讨论文件首先概述AI/ML 一般应用的考量因素和规范,最后提出问题,以征求利益攸关方对这些考量因素的反馈,进一步确定AI/ML 用于药品开发的潜在规范,为FDA 进一步确定整个药品开发过程中应用AI/ML 的机遇和挑战提供帮助。
4.1 采用AI/ML 的总体标准与规范
国际社会和美国联邦政府越来越重视促进AI 创新和应用,包括促进可信赖的和符合伦理的AI[73-78]。为促进AI 的技术进步而制定跨部门和特定部门标准迅速增加。2019 年8 月,美国国家标准与技术研究院(NIST)发布《美国在人工智能方面的领导地位:联邦参与制定技术标准和相关工具的计划》(U.S. Leadership in AI:A Plan for Federal Engagement in Developing Technical Standards and Related Tools),帮助确保技术标准的使用,推动AI 应用的创新、信任和信心[79-80]。该计划确定了制定AI 标准的几个重点领域,包括数据和知识、性能测试和报告方法、风险管理和可信度等。国际标准化组织(ISO)、国际电气和电子工程师协会(IEEE)和国际电工委员会(IEC),也在开发相关的AI/ML 标准和工作产品,解决数据质量、可解释性和性能等基本问题,此外还在研究某些行业的具体应用。由美国机械工程师协会(ASME)制定核查和验证(V&V 40)风险知情的可信度评估框架,用于评价医疗器械计算模型的可信度[81],之后被用于模型提供信息的药品开发中[82-83]。V&V 40 标准并非专门针对AI/ML 开发,没有具体规定活动或定义标准,为确定模型在特定使用或应用环境下的可信度,针对医疗器械和模型提供信息的药品开发,对该标准做出相应调整[84-85]。
除了用于评估医疗器械计算模型预测能力的V&V 40 标准外,FDA、加拿大卫生部和英国药品与健康产品管理局(MHRA)联合发布10 项指导原则,为使用AI/ML 的医疗器械制定机器学习规范(GMLP)提供依据。该指导原则包括采用产品全生命周期的方法,在整个产品开发过程中利用多学科专业知识,深入了解如何将模型整合到临床工作流程中。这些原则还强调在临床研究人群中充分代表年龄、性别、种族等的重要性;控制偏倚;提高普遍适用性;提供足够的透明度,提供清晰和必要的信息,例如产品的预期用途和适应症,用于测试和训练模型的数据,以及已知的局限性。GMLP 强调监测已部署的模型性能和管理模型再培训风险的重要性。FDA CDRH 之前曾讨论过GMLP 对医疗器械的作用,并在2019 年发布关于修订基于AI/ML 的医疗器械软件(SaMD)的拟议框架。该框架提出了一个预先确定的变更控制计划机制,申办方可以主动指定对包含AI/ML 的设备软件的拟定修改,以及用于确保其安全性和有效性的方法,为AI/ML 支持的器械奠定基础,提高适应性[86]。
尽管上述标准、规范并非专门为药品开发而制定,但探讨这些标准对药品开发和计划与药品一起使用的医疗器械开发的效用和适用性,以确保一致性和连贯性。
4.2 药品开发中AI/ML的考量因素和规范讨论
根据AI/ 分子生物学在药品开发中的多个应用领域,FDA 正在考虑相应的方法,以便在不断扩展的知识体系,以及在对药品开发中使用AI/ 分子生物学的机会和挑战的清晰认识的支持下,对在药品开发中的采用AI/ML 提供监管清晰度。虽然讨论文件第Ⅲ.A 节中概述的某些标准和实践有可能被调整以解决药品开发中AI/ML 的使用问题,但在药品开发中使用AI/ML 可能会引起特定的挑战,可能需要重视其他考量因素。FDA 强调,不应将讨论文件视为FDA 的指南或政策,指南文件也不意味着在药品开发中采用AI/ML 的所有具体方法。指南文件用于反馈利益攸关方的看法,为将来与利益攸关方讨论,为将来的监管活动提供帮助、提供信息。
根据美国政府问责局AI 问责框架的总体原则,FDA 的CDER、CBER、CDRH(包括DHCoE)旨在与利益攸关方展开讨论,并就药品开发中的AI/ML 的3 个关键领域征求意见。这3 个关键领域包括:①以人为主导的治理、问责制和透明度;②数据质量、可靠性和代表性;③模型开发、性能、监控和验证。采用基于风险、AI/ML 特定使用环境所带来的风险水平相称的措施。
4.2.1 以人为主导的治理、问责制和透明度
以人为主导的AI/ML 治理,有助于确保遵守法律和伦理价值观,问责制和透明度对于发展值得信赖的AI 至关重要。这种治理和明确的问责制可延伸到药品开发过程中AI/ML 的计划、开发、使用、修改和叫停等各个环节。
作为治理的一部分,可以采用考虑使用环境的风险管理计划来识别确定和减轻风险。这种方法可以通过跟踪、记录关键步骤和决策,包括所有偏差的根本原因,以及警惕性监督和审计的流程,来帮助指导文档、透明度和可解释性的级别。透明度和文件记录可提供有关AI/ML 的最初规划、开发、功能以及在具体使用环境中所有修改的关键见解,可解释性可提供产出的附带证据或理由。
讨论文件提出的问题包括:①在药品开发中采用AI/ML 的哪些具体用例或应用,最需要额外的监管清晰度;②对于在药品开发中采用AI/ML,透明度意味着什么[ 例如,透明度可以被认为有关AI/ML 模型的适用信息,涵盖使用、开发、性能以及(如果存在)逻辑],清晰地传达给监管机构与其他利益攸关方的程度[87];③根据所积累的经验,在药品开发过程中使用AI/ML,透明度的主要障碍和促进因素,以及所涉及的情况;④ AI/ML 用于药品开发时,在人为参与方面,利益攸关方有哪些基于风险的、有意义的好做法;⑤制定了哪些规程加强和实现可追溯性和可审计性;⑥如何管理质量标准出台之前的活动,以及如何捕捉和监测变更,确保在药品开发中安全和有效地采用AI/ML。
4.2.2 数据质量、可靠性和代表性
AI/ML 对用于训练、测试和验证的数据的属性或特征特别灵敏。尽管并非AI/ML 特有,但通常情况下,缺失的数据、偏倚和数据漂移均为重要的考量因素。确保数据质量、可靠性以及数据适合使用(即与特定的预期用途和人群相关)成为关键。需要加以考虑的潜在的数据相关问题包括以下几个方面。
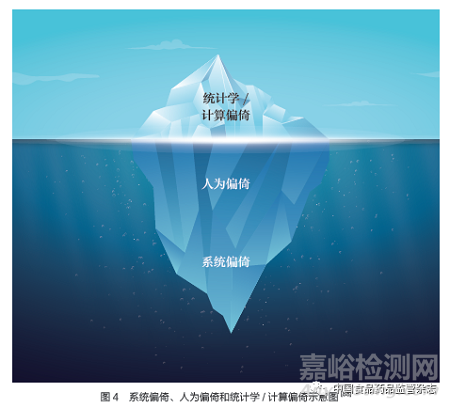
偏倚:AI/ML 可能会放大基础输入数据中预先存在的偏倚。美国国家标准与技术研究院发布文件,阐述了来自人为、系统和统计学/ 计算的三类偏倚(图4),以及如何在委托、设计、开发和部署可用于生成预测、建议或决策的AI 技术(例如,算法决策系统)中发生,AI 系统在什么情况下可能造成社会危害[88]。
完整性:数据完整性、一致性和准确性[89]。
隐私权和安全保障:数据保护和隐私权,与数据分类和系统技术特征有关。
溯源:记录一段数据(在数据库、文档或数据仓库中)的来源,同时解读如何以及为什么到达现行位置[90]。溯源描述了元数据或有关数据的额外信息,可以帮助回答诸如谁创建数据以及何时创建数据等问题[91]。
相关性:有充分数据可供使用,并适用于预期用途。
可复制性:旨在回答相同问题、各自获取数据的多项研究获得一致结果[91]。在过程的早期明确数据访问权非常重要。
可重复性:使用相同的输入数据、计算步骤、方法和代码以及分析条件,获得一致结果[92]。尽管不能确认有效性,但需要可重复性所需的透明度,对设计和操作决策的有效性开展评估[93]。
代表性:对生成证据的样本与目标人群有足够的相似性的置信度。在患者体验数据的背景下,代表性包括样本的体验、观点、需求和优先事项与预期的患者群体充分相似的程度[94]。
所涵盖的问题包括:①在药品开发过程中,AI/ML 还有哪些额外的数据考量;②开发机构、制造商和其他利益攸关方目前采用哪些做法来帮助确保AI/ML 的完整性或解决这些问题,诸如偏倚、数据缺失和其他数据质量考虑,有利于在药品开发中使用AI/ML ;③利益攸关方采用了哪些关键做法来帮助确保数据隐私权和安全保障;④利益攸关方采用了哪些关键做法来帮助解决可重复性和可复制性问题;⑤开发机构采用了什么样的流程来识别确定和管理偏倚。
4.2.3 模型开发、性能、监控、验证
在评估AI/ML 模型的开发和性能时,所采用的模型是重要的考量因素,包括通过预先指定步骤的做法和明确记录开发和评估模型的标准。考虑模型风险和可信度可能也很重要;可信度目标与相关措施的选择受制于模型风险。可信度指特定使用环境下计算模型预测能力的可信程度。包括在可行的情况下,记录组件层面(例如,模型和非水平组件,包括指标和评估每个组件的性能和结果)和系统层面(例如,评价方法、性能指标和结果)的性能和方法,以衡量不确定性。可信度的证明通常包括一种基于风险的方法,即呈现最高风险的用途通常需要标准最高的证据,根据相关风险需要有梯度的证据(即为非严重医疗状况的早期药物开发提供信息,而为关键医疗状况评估药物安全性和有效性)。模型风险由模型影响(模型在特定决策的全部证据中的权重)和决策后果(错误决策的潜在后果)2个因素决定,这2 个因素取决于相关的使用环境。
在平衡性能和可解释性方面,考虑AI/ML 模型复杂性非常重要。在确定复杂模型(例如,人工神经网络模型)具有相似性能的情况下,选择更为传统和更为简明(即参数更少)的模型,可能具有整体优势。
监测和记录AI/ML 模型的监测工作很重要,确保可靠、相关,并在一段时间内保持一致。包括记录监测结果和为确保AI/ML 产生预期结果而采取的所有整改措施。随后的评估(例如,上市后的安全监测、监督)可以提供关于流程和真实世界模型性能的宝贵反馈。真实世界模型性能包括可由真实世界数据采集和监测支持的具体应用,例如电子病历、产品、疾病登记等。基于真实世界性能的再训练,能够为模型性能提供重要的深入了解,在这种再训练之后,监测和记录AI/ML模型以适当地管理风险可能变得很重要。
数据方面的考量还包括提供用于开发AI/ML 模型的训练数据集的细节,以及在采用独立外部测试数据支持验证和确认[ 外部有效性(external validity)] 情况下的性能。一般来讲,对于特定使用环境,具有足够质量的数据将具备对采用AI/ML 方法所针对的人群的代表性,这一点很重要。重要的是有助于确保AI/ML 模型得到验证,生成对模型使用可信的结果。可靠性活动包括验证软件代码和计算、验证模型,以及评估验证评价对使用环境的适用性。这些活动包括考虑测量模型预测的不确定性水平。在完成可信度活动后,可开展评价,以确定模型的使用是否足够可信,以及在监管所涉范围内,是否能够接受模型。所涵盖的问题包括:①利益攸关方目前使用的工具、流程、方法和规范的用例;②记录可用于药品开发的AI/ML 模型的开发和性能(例如,CONSORT-AI、SPIRITAI)[31,95] ;③针对具体使用环境选择模型的类型和算法;④确定在什么情况下采用特定的方法验证模型,并在特定的使用环境下测量性能(例如,选择相关的成功标准和性能测量);⑤如何评价透明度和可解释性,提高模型的透明度;⑥解决准确性和可解释性的问题(例如,模型可能提供更高的准确性,同时在可解释性方面存在局限的情况);⑦是否针对AI/ML 模型的开发选择开源AI 软件,采用开源AI 软件时有哪些注意事项;⑧是否采用真实世界数据性能来监测AI/ML 性能。
5、 结语
AI/ML 在医药产品开发、生产、上市后监测中的运用,呈现出在多种环境下,与多种类型的软件、硬件一起使用的跨平台(technology-agnostic) 特征。面对技术的不断发展,监管机构需要与行业和利益攸关方达成共识,在推动相关技术运用的同时,充分认识到相关技术的风险和面临的挑战,通过与行业和利益攸关方协作,充分利用创新技术,共同推动AI/ML 在相关领域的运用。
引用本文
姚立新.浅析人工智能/ 机器学习用于药品开发——基于FDA 讨论文件的探讨[J].中国食品药品监管.2023.07(234):44-57.