今日头条
和铂MSLN-ADC获批实体瘤临床。和铂医药靶向人间皮素(MSLN)的ADC新药HBM9033获FDA批准开展I期临床,评估用于治疗晚期实体瘤的安全性、耐受性、药代动力学和抗肿瘤活性。这是该公司首款进入临床开发的ADC新药,采用独特的抗体和连接符载荷设计。MSLN是一种细胞表面糖蛋白,在恶性间皮瘤、胰腺癌、卵巢癌和肺癌等多种肿瘤中过表达。
国内药讯
1.云顶新耀引进肾病新药澳门报产。澳门药监部门受理云顶新耀从Calliditas公司引进的布地奈德迟释胶囊(Nefecon,耐赋康)的新药上市许可申请(NDA),用于治疗IgA肾病成人患者。Nefecon是全球获批治疗IgA肾病的首个靶向药,在临床(NefIgArd)试验中较安慰剂降低患者27% (P=0.0003) 的尿蛋白肌酐比。云顶新耀拥有Nefecon在大中华地区和新加坡开发以及商业化权利。
2.永泰肿瘤细胞疗法拟纳入突破性疗法。永泰生物基于活化的自体淋巴细胞(AAL)技术开发的多靶点肿瘤细胞免疫治疗产品“扩增活化的淋巴细胞(EAL®)”获CDE拟纳入突破性治疗品种,用于预防原发性肝细胞癌根治性切除术后复发。预期该产品将于2024年获批上市。据悉,永泰生物还计划将EAL®的临床适应症扩展至肺癌、胃癌和急性髓系白血病等实体瘤的治疗。
3.基石PD-L1单抗胃癌Ⅲ期临床成功。基石药业PD-L1单抗择捷美(舒格利单抗注射液)联合化疗一线治疗PD-L1表达≥5%、局部晚期或转移性胃/胃食管结合部腺癌的Ⅲ期研究(GEMSTONE-303)达到预设的主要终点。与安慰剂联合化疗相比,舒格利单抗组合显著延长患者的无进展生存期(PFS)和总生存期(OS)。详细数据将在学术会议上公布。今年2月,该新药上述适应症上市申请已获得NMPA受理。
4.广州知易活体生物药获批III期临床。知易生物首个活体1类生物药SK08活菌散获国家药监局批准开展Ⅲ期临床,评估用于治疗腹泻型肠易激综合征(IBS-D)的有效性与安全性。SK08已在Ⅱ期临床中达到预设的有效性终点指标,整体改善患者的腹痛和腹泻症状,并具有良好的安全性。除IBS外,SK08已获批多个适应症的临床许可(包括溃疡性结肠炎和肿瘤),有望成为国内首个获批上市的活体生物药。
5.杭州浩博乙肝ASO疗法获批临床。浩博医药反义寡核苷酸药物AHB-137获FDA批准开展用于慢性乙肝病人的临床试验。这是一项国际Ⅰ期临床,目前浩博医药正在新西兰、中国评估该药用于慢性乙肝患者中的安全性、耐受性、药代动力学和初步药效(NCT05717686)。AHB-137可靶向所有HBV RNA将其降解,在临床前研究中已显示出对乙肝表面抗原的降低能力。
6.布瑞迅OX2R拮抗剂获批失眠临床。布瑞迅药业1类化药BrP-01096片获国家药监局临床许可,拟用于失眠症的治疗。BrP-01096是一款小分子选择性食欲素受体(OX2R)拮抗剂,通过选择性地抑制OX2R以改善睡眠,包括加快入睡速度和延长睡眠时间,具有起效快、耐受性好、长期服用耐药风险低等特点。全球范围内尚无同类药物获批上市。
国际药讯
1.艾伯维IL-23抗体报结肠炎NDA。艾伯维已向FDA和EMA递交了IL-23抑制剂利生奇珠单抗(Skyrizi)注射液及其皮下注射剂型的新适应症上市申请,用于治疗中重度活动性溃疡性结肠炎(UC)。在III期诱导研究INSPIRE中,risankizumab治疗较安慰剂显著提高12周时的临床缓解率(20.3%vs6.2%);在维持研究COMMAND中,risankizumab与对照组相比,患者在52周时达到临床缓解的患者比例更高(40%和38%,vs25%,p<0.01)。
2.诺华降脂疗法Ⅲ期长期疗效积极。诺华靶向PCSK9的小干扰核酸(siRNA)疗法Leqvio(inclisiran)联合他汀类药物,用于辅助治疗动脉粥样硬化性心血管疾病(ASCVD)、ASCVD或杂合体家族性高胆固醇血症(HeFH)风险增加患者的Ⅲ期临床(ORION-8)扩展研究结果积极。最新数据显示,每年两次Leqvio辅助治疗可持续6年降低患者的低密度脂蛋白胆固醇(LDL-C);药物安全性与既往结果一致。详细结果将公布于ESC2023年会上。
3.创新口服TTR稳定剂达Ⅲ期临床主要终点。BridgeBio公司新一代转甲状腺素蛋白(TTR)小分子稳定剂acoramidis将在ESC2023大会上公布其用于治疗伴有心肌病的转甲状腺素蛋白介导的(ATTR)淀粉样变性(ATTR-CM)患者的Ⅲ期临床(ATTRibute-CM)积极数据。按全因死亡率、心血管相关住院频率、NT-proBNP较基线变化和6分钟步行距离较基线变化的优先顺序层级分析,Win比率(Win ratio)达到1.8(p<0.0001),acoramidis组与安慰剂组生存率分别为81%和74%。该公司预计年底前向FDA递交新药申请。
4.拜耳干细胞疗法PD早期临床积极。拜耳及其旗下BlueRock公司计划在国际帕金森病和运动障碍大会上公布干细胞衍生疗法bemdaneprocel(BRT-DA01)治疗帕金森病的Ⅰ期临床积极结果。该研究达到主要终点,bemdaneprocel在所有12例受试者中耐受性良好;高剂量bemdaneprocel组受试者在一年后处于“开通”状态的时间较基线多2.16小时,且没有出现运动障碍;处于“关闭”状态的时间相应减少1.91小时。
5.肿瘤电场治疗卵巢癌III期研究失败。Novocure公司肿瘤电场治疗(TTFields)与紫杉醇联合用于铂类耐药性卵巢癌患者的III期ENGOT-ov50/GOG-3029/INNOVATE-3临床未达到总体生存期(OS)主要终点。与紫杉醇相比,TTFields联合紫杉醇治疗未能显著改善患者的 OS (中位OS:12.2个月vs11.9个月,HR:1.008);TTFields治疗耐受性良好,未增加全身毒性。Novocure计划全面评估ENGOT-ov50试验数据,包括亚组分析。再鼎医药拥有该产品的中国权益。
6.丹纳赫57亿美元收购Abcam。8月28日,丹纳赫宣布将以每股24美元的价格收购英国生命科学用品制造商Abcam,总交易金额为57亿美元左右。Abcam公司成立于1998年,专注于为科学家提供各种实验室产品,如用于药物发现和诊断的蛋白质和抗体。此次收购将有助于丹纳赫为客户提供全方位服务。2023年上半年,Abcam营业收入为2.03亿欧元,预计全年营收4.3亿欧元。
医药热点
1.上海市六院安徽医院开诊。8月28日,坐落于中国科学技术大学附属第一医院(安徽省立医院)北区南地块的上海市第六人民医院安徽医院(国家创伤区域医疗中心)揭牌开诊,这也是安徽省首个,全面开诊的国家区域医疗中心。上海市六院安徽医院用地面积142亩,总建筑面积21万平方米,设置床位1000张,旨在建成集医疗、教学、科研、预防和保健为一体,特色突出的现代化、高水平国家创伤区域医疗中心,提升安徽省创伤诊疗技术能力和服务水平。
2.厦门检出今年首例登革热病例。8月28日,厦门海关所属机场海关在入境航班中检出厦门口岸今年首例登革热病例。该旅客体温高达38.4°C,近期有蚊虫叮咬史,有畏寒、面色潮红、眼部干痛等症状,结合临床症状和流行病学调查,该旅客被综合诊断为登革热感染。目前,海关已告知该旅客检测结果并给予健康建议,同时将病例情况通报地方卫健部门,做好后续处置工作。
3.山西省肝脏移植中心获批成立。近日,山西省卫健委下发《关于同意山西医科大学第一医院成立山西省肝脏移植中心的批复》,山西医科大学第一医院正式获批成立“山西省肝脏移植中心”。未来,山西医科大学第一医院将充分利用其优质医疗资源,在目前开展的4种术式基础上,逐步开展儿童活体肝移植、劈离式肝移植、辅助肝移植及多米诺肝移植,让有肝移植适应证的终末期肝病患者得到更加规范、高效的治疗,加速提升山西省器官移植技术水平和术后管理水平。
评审动态
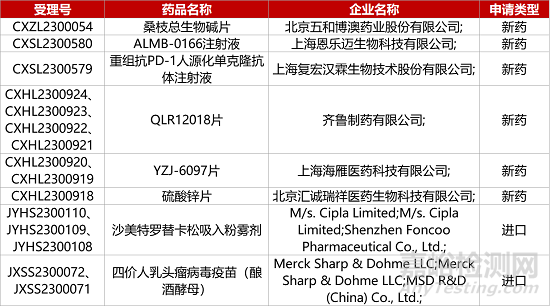
1. CDE新药受理情况(08月29日)
2. FDA新药获批情况(北美08月28日)