经过一两年甚至更久的研究开发筹备,又经历递交前长达数周甚至数月加班制作申报资料,大家都希望项目受理后可以顺利获批临床或上市,然而前期的一点疏漏可能导致整个的项目进程受阻。在此,我总结了近期经历的撤回及提交异议的一点小经验,希望可以为有同样困扰的同行提供一些信息,当时更希望这些信息您永远都用不到。
如果递交注册申请后,CDE老师经过审评,结论为不通过,那么在审评的过程中,会将项目计时暂停,转到异议通道。以本次IND申请为例,在40-50工作日收到CDE老师的审评意见,审评暂停计时,挂到异议通道。根据和其他同行老师的沟通,有一些项目若存在更为明显的问题,会在更早期如三十多个工作日的时候收到老师的反馈,因为项目缺少关键的试验,老师直接建议项目撤回。
相关的审评意见可以在“不批准异议申请”的通道找到。根据申报产品为制剂或原料,选择不同的通道即可看到老师的意见。其中,有一份word版资料为综合审评意见,会注明项目不予批准的原因(此处要注意,对于其他部门未导致不批准结论的审评意见,此word文件中不做展示,可以后续和项目的主审老师进行沟通,看是否可以拿到其他老师的审评意见,便于对项目进行改进)。同时可以看到一份不予通过的审评结论告知书,告知书中会再次告诉申请人不予通过的原因,同时告诉申请人下一步可以采取的行动。
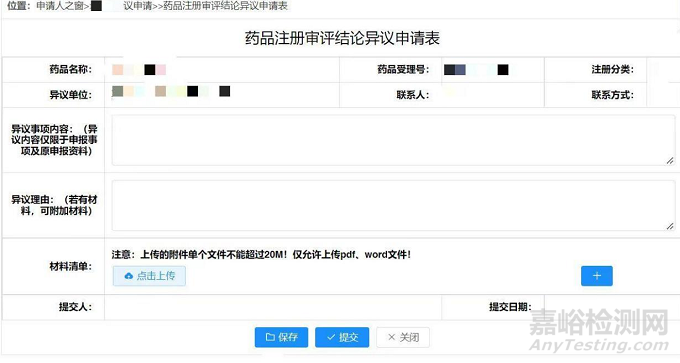
如果申请人选择通过申请人之窗提出异议,需要参考如下《药品注册审评结论异议申请表》进行相关资料的准备,相关的材料为:
1. 申请人之窗或邮件打印的不予通过的申请结论材料。
2. 药品注册审评结论异议申请表和异议报告。注意,申请表中可以上传支持性的资料,但是仅限于20MB以内的PDF或word文件。
3. 授权委托书
4. 境外申请人制定中国境内的企业法人办理相关注册事项的,可由注册代理提出异议申请,同时需要提交原委托文书复印件以及注册代理机构的营业执照复印件。
异议的相关资料仅限于原申报事项和原申报资料。如果想利用异议的机会跟CDE老师探讨新的试验设计思路或项目的整改方案,原则上是不允许的。
我司最终未选择提交异议申请,但是经过同行交流,有些公司在提交异议申请获得和CDE的开会资格后,CDE老师并未改变不批准的决定。但是申请人可以利用本次机会和CDE老师充分进行项目探讨,了解老师的想法,明确下一步的行动安排。
根据2020年3月30日颁布的《药品注册管理办法(国家市场监督管理总局令第27号)》
第九十条 药品注册期间,对于审评结论为不通过的,药品审评中心应当告知申请人不通过的理由,申请人可以在十五日内向药品审评中心提出异议。药品审评中心结合申请人的异议意见进行综合评估并反馈申请人。
申请人对综合评估结果仍有异议的,药品审评中心应当按照规定,在五十日内组织专家咨询委员会论证,并综合专家论证结果形成最终的审评结论。
申请人异议和专家论证时间不计入审评时限。
第九十三条 药品注册申请审批结束后,申请人对行政许可决定有异议的,可以依法提起行政复议或者行政诉讼。
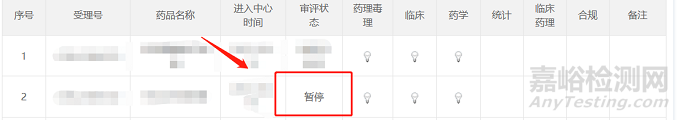
项目处于异议流程中时,在药审中心网站-信息公开-审评任务公示栏中,项目的状态会变为暂停。
根据2020年3月30日颁布的《药品注册管理办法(国家市场监督管理总局令第27号)》
第八十八条 药物临床试验申请、药物临床试验期间的补充申请,在审评期间,不得补充新的技术资料;如需要开展新的研究,申请人可以在撤回后重新提出申请。
第八十九条 药品注册申请受理后,申请人可以提出撤回申请。同意撤回申请的,药品审评中心或者省、自治区、直辖市药品监督管理部门终止其注册程序,并告知药品注册核查、检验等技术机构。审评、核查和检验过程中发现涉嫌存在隐瞒真实情况或者提供虚假信息等违法行为的,依法处理,申请人不得撤回药品注册申请。
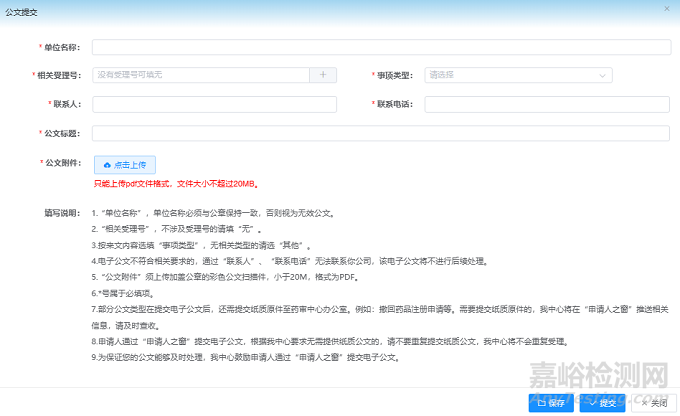
如果申请人对CDE老师的审评结论没有异议,同时又想尽快将项目状态从暂停调整回正常,可以通过撤回流程进行操作。撤回申请可以通过申请人之窗-公文提交栏目先行递交电子公文。注意根据公文提交中的填写说明第7项,撤回药品注册申请的公文同时需要邮寄纸质原件至药审中心办公室。电子公文提交当天,申请人之窗系统提示已收文,纸质公文签收当天或第二天,项目异议通道撤回,项目重新启动计时。项目重新回到排队序列中,基本和同期收到默示许可的项目一同收到通知书,只是撤回项目会收到《药品注册申请终止通知书》。通知书内容会显示根据《药品注册管理办法》第八十九条及申请人公文,同意本品注册申请撤回,终止注册程序。
项目异议通道撤回后至发放药品注册终止通知书之前,在药审中心网站-信息公开-审评任务公示栏中,项目会重新回到排队序列中,项目状态会变为排队待审评。
不论项目撤回或不批准,在下次申报时都需要在申请表的“历次申请情况”中进行呈现。根据填表说明第29项“历次申请情况”的要求,申请人需要填写由同一申请人申报的该品种末次批准上市至本次提出申请期间提出的所有相关申请情况(若该品种仍未批准上市的,应从首次申请开始填写历次申请情况)。
在这个过程中,笔者总结了一些思考,希望可以抛砖引玉,也请经验丰富的老师帮忙进行补充:
1) 需要撤回的情况:
有些缺陷很明显的项目,如某些关键研究未进行考察、或试验设计有明显的缺陷、或取得的试验数据很明显无法支持临床设计等,建议直接进行撤回操作。
此时需要申办方自行进行评估,如果对项目信心不足,且希望尽快可以对项目存在的问题进行改进完善,建议还是尽早撤回,尽早提交新的注册申请。否则按照异议的流程,后续还要等待至少五十日、且最终的结果还是大概率审评不通过项目撤回,不如抓紧时间进行试验和资料的完善。让老师看到申办方对项目的努力及对审评意见的态度。
2)可以进行异议尝试的情况:
认为项目中的信息足够支持注册申请、或认为部分信息老师在初次审评的时候存在疏漏和理解错误、或希望借此机会和CDE老师对项目中存在的问题进行深入探索讨论。
在申办方经验不够丰富,或对这个项目目前取得的相关数据解读不够深入,或靶点较新、行业里并无太多经验,通过异议和CDE老师进行会议讨论可以帮申办方更好的明白CDE老师的审评意见,请老师帮忙指明项目需要努力的方向,帮助项目进行更好的改善和提升。这是很好的学习机会。当然前提是项目时间允许,能够让大家停下来通过异议流程将项目梳理的更清晰明确。
如果申报资料本身质量就不高,切记不要利用异议的机会反复阐述注册资料中已提及的信息,不要强行和老师argue、硬说数据没问题,更不要让老师帮忙确认新的试验或方案设计等,这些操作只会的增加CDE老师和申办方内部无意义的工作量,让CDE老师对项目的印象分更差。
以上是我近期整理的注册申请撤回及提交异议的一点经验,希望对同行小伙伴有帮助,更希望您用不到该经验。