今日头条
乐普TF靶向ADC获胰腺癌孤儿药认定。乐普生物TF靶向ADC新药MRG004A获FDA授予用于治疗胰腺癌的孤儿药资格。TF的异常表达通常与肿瘤生长、血管生成、肿瘤转移和临床治疗预后差相关。目前,乐普生物正在美国及中国开展国际I/II期临床研究,乐普生物已观察到胰腺癌、三阴性乳腺癌及宫颈癌的抗肿瘤活性信号。
国内药讯
1.阿柏西普长效眼内注射液中国报产。拜耳申报的阿柏西普眼内注射溶液上市申请获CDE受理,推测这是阿柏西普的高剂量8mg长效制剂。阿柏西普是一款VEGFR-Fc融合蛋白,FDA已于今年8月批准阿柏西普8mg上市,用于治疗湿性年龄相关性黄斑变性(wAMD)、糖尿病性黄斑水肿(DME)和糖尿病视网膜病变患者。在临床试验中,与8周一次Eylea(2mg)标准治疗组相比,每12周一次或每16周一次8mg阿柏西普给药组患者的视力改善达到非劣效性标准。
2.迈威新一代长效升白药报产。迈威生物注射用重组(酵母分泌型)人血清白蛋白-人粒细胞集落刺激因子 (I)融合蛋白8MW0511的新药上市申请获CDE受理,用于成年非髓性恶性肿瘤患者在接受骨髓抑制性抗癌药物治疗时降低中性粒细胞减少症的发生率。在III期研究中,8MW0511联合化疗治疗乳腺癌较津优力®在4级中性粒细胞减少的统计达到非劣效性。扬子江拥有该产品在合作区域内的独家权益。
3.百奥泰PD-1抗体获批子宫内膜癌临床。百奥泰PD-1抗体BAT1308注射液获国家药监局临床许可,拟联合含铂化疗用于一线治疗晚期或复发性错配修复蛋白缺失型(dMMR)子宫内膜癌。BAT1308通过与PD-1结合,阻断PD-1与PD-L1、PD-L2的相互作用,以恢复和提高T细胞的免疫杀伤功能。目前,该产品正在II/III期研究中评估联合含铂化疗±贝伐珠单抗用于一线治疗PD-L1阳性(CPS≥1)的持续、复发或转移性宫颈癌的潜力。
4.恒瑞JAK1抑制剂缓释片获批红斑狼疮临床。恒瑞医药1类化药SHR0302缓释片获国家药监局临床许可,拟开发用于治疗系统性红斑狼疮。SHR0302是一款JAK1抑制剂,可通过抑制JAK1信号传导发挥抗炎和抑制免疫的生物学效应。此前,恒瑞医药开发的SHR0302片已向CDE递交用于治疗中重度特应性皮炎(AD)、活动性强直性脊柱炎(AS)以及类风湿关节炎的多个新药申请。
5.阿斯利康CD19/CD3双抗中国报IND。阿斯利康1类生物制品AZD0486(TNB-486)的临床试验申请获CDE受理,拟用于治疗复发性或难治性B细胞急性淋巴细胞白血病(r/r B-ALL)。TNB-486是TeneoTwo公司(已被阿斯利康收购)开发的一款CD19/CD3双抗。公布于ASH会议上的国际Ⅰ/Ⅱ期研究显示,AZD0486单药治疗复发/难治性B细胞非霍奇金淋巴瘤患者具有较好的安全性及初步疗效。
6.和铂MSLN靶向ADC授权辉瑞。和铂医药全资子公司诺纳生物与辉瑞就靶向人间皮素(MSLN)抗体偶联药物(ADC)HBM9033的全球临床开发和商业化签订独家授权协议。MSLN是一种在多种实体瘤中上调的肿瘤相关抗原(TAA)。根据协议,Nona Biosciences将获得5300万美元的预付款和近期付款,高达10.5亿美元的开发和商业里程碑潜在后期付款,以及产品的销售分成。
国际药讯
1.依氟鸟氨酸获批维持治疗神经母细胞瘤。US WorldMeds公司的鸟氨酸脱羧酶抑制剂Iwilfin(eflornithine,依氟鸟氨酸)192mg片剂获FDA批准上市,用于降低患有高危神经母细胞瘤且对先前的多药物、多手段治疗(包括抗GD2免疫疗法)至少有部分应答的成人和儿科患者的复发风险。在一项单臂外部对照研究(研究Ⅲb;NCT02395666)中,与外部对照组(ANBL0032;NCT00026312)相比,Iwilfin维持治疗将复发风险降低52%,死亡风险降低68%。
2.默沙东HIF-2α抑制剂获批治疗肾癌。默沙东“first-in-class” 缺氧诱导因子-2α(HIF-2α)抑制剂Welireg(belzutifan)获FDA批准补充新药申请(sNDA),用于治疗晚期肾细胞癌经治患者。在Ⅲ期临床LITESPARK-005中,与依维莫司相比,Welireg显著改善患者的无进展生存期(PFS),使患者的疾病进展或死亡风险降低25%(HR=0.75,95% CI:0.63-0.90;p=0.0008)。
3.重磅ADC/K药组合获FDA完全批准。FDA完全批准安斯泰来/Seagen开发的Nectin-4-ADC药物Padcev(enfortumab vedotin)与默沙东PD-1抗体Keytruda构成的组合疗法,用于一线治疗局部晚期或转移性尿路上皮癌(la/mUC)成人患者。在Ⅲ期EV-302/KN-A39临床中,与化疗相比,Padcev/Keytruda组合显著延长患者的PFS和OS,使疾病进展或死亡风险降低55%,死亡风险降低53%。
4.PDE4抑制剂泡沫剂获批治疗脂溢性皮炎。Arcutis公司PDE4抑制剂改良型新药0.3%罗氟司特(Zoryve)泡沫制剂获FDA批准上市,用于治疗9岁及以上脂溢性皮炎患者。在III期STRATUM研究中,Zoryve治疗组较安慰剂达到IGA评分为0或1且改善2%的患者比例显著提高(79.5%vs58.0%,P<0.0001)。2022年7月,Arcutis开发的罗氟司特(0.3%)乳膏已在美国获批,用于斑块状银屑病的治疗。华东医药拥有罗氟司特乳膏和泡沫制剂在大中华区以及东南亚等国权益。
5.LSD衍生物焦虑Ⅱb期临床积极。Mind Medicine公司麦角酸二乙酰胺(LSD)衍生物MM-120治疗广泛性焦虑障碍(GAD)的Ⅱb期临床达到主要终点。与安慰剂相比,MM-120(100μg)治疗组第4周时汉密尔顿焦虑评分量表(HAM-A)评分降低7.6点(-21.3vs-13.7;p<0.0004);临床整体印象-严重程度(CGI-S)平均分数从4.8降至2.4,疾病严重程度降低了两个级别(p<0.001)。MM-120总体耐受性良好,大多数不良事件为轻中度。
6.AI小分子药物公司Totus完成B轮融资。Totus Medicines公司宣布完成由DCVC Bio领投的6600万美元B轮融资。Totus Medicines致力于将新型DNA编码共价库技术与人工智能/机器学习(AI/ML)相结合来发现和开发小分子药物。该公司专有技术平台能够在细胞背景下针对数百个靶标筛选数十亿种化合物,以发现创新、“不可成药”药物靶点来提高药物成功开发的可能性。Totus Medicines先导项目TOS-358是一款高特异性、强效的PI3Kα抑制剂。
医药热点
1.国家疾控局建议打疫苗、戴口罩。国家疾控局在12月15日晚间发文表示,自11月首次发现本土奥密克戎变异株JN.1以来,截至12月10日,我国本土病例中共监测到7例JN.1变异株。后续受国际流行株和输入病例影响,不排除JN.1变异株成为国内优势新冠流行株的可能。今年11月以来,JN.1变异株在全球流行毒株中的占比迅速增加,从11月初的4%增长至12月初的30%左右。截至12月10日,全球至少有40个国家或地区监测到JN.1变异株。国家疾控局建议公众科学佩戴口罩,及时接种疫苗。
2.上海交通大学医学院新增一所附属医院。近日,上海市教委和上海市卫健委联合发文,正式批准将松江区中心医院列为上海交通大学医学院附属医院。未来,松江区中心医院将进一步巩固前期附属医院建设成果,继续推进医院与上海交通大学医学院松江研究院深度融合,力争3至5年内达到三级甲等综合性医院标准。逐步建设成为上海西南大门的示范型区域性医疗中心。
3.北大医院新增胆道疾病MDT门诊。近日,北大医院“胆道疾病多学科(MDT)门诊”正式开诊。该门诊由肝胆胰外科主任田孝东牵头,旨在为胆道系统的疑难复杂良性病例、恶性肿瘤患者的个体化治疗、健康恢复提供一站式诊疗服务平台。患者挂一次号可同时享受肝胆胰外科、感染疾病科、消化内科、内镜中心、介入血管外科、肿瘤化疗科、放射治疗科、医学影像科、病理科等多科室诊疗服务,从而提升就医体验。
评审动态
1. CDE新药受理情况(12月16日)
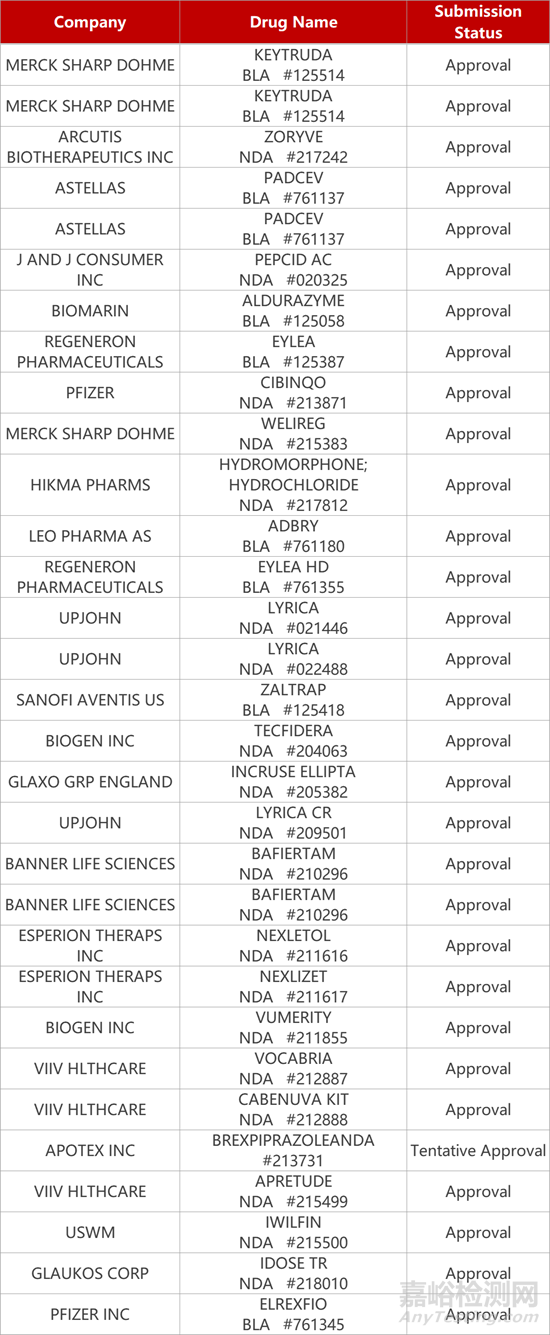
2. FDA新药获批情况(北美12月15日)