【问】药品上市后生产场地变更,普通口服固体制剂中间产品/待包装产品的存放时限有哪些技术要求?
【答】中间产品是指完成部分加工步骤的产品,尚需进一步加工方可成为待包装产品。待包装产品是指尚未进行包装但已完成所有其他加工工序的产品。存放时限是指中间产品/待包装产品在规定条件下存放并确保能持续符合既定质量标准的时间。
在药品生产过程中,需要长时间贮存或需要特殊贮存的中间产品/待包装产品,申请单位应予以重视。在场地变更研究工作中,场地变更前后生产工艺、关键设备、贮存条件、存放形式、原辅料和包材等发生变更时,应通过风险评估判断是否需要对存放时限进行重新研究、确认或验证。
不同剂型中间产品/待包装产品的存放时限需考察的内容各有侧重,申请单位应在风险评估的基础上,结合剂型、中间产品/待包装产品的特点,开展必要的中间产品/待包装产品存放时限研究,合理设计考察时间点和检测项目。通常选择一个批次或多个批次的中间产品/待包装产品,通过稳定性试验研究结果和实际生产需要,确定合理的存放时限。中间产品/待包装产品的存放时间不应超过规定的存放时限。
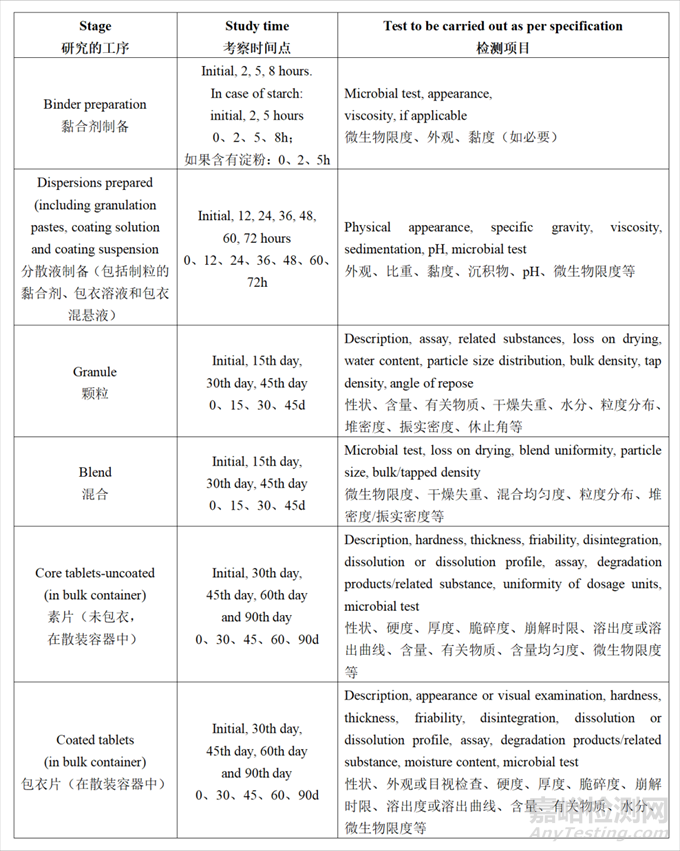
WHO存放时限研究通用指南中提供了口服固体包衣片可供参考的存放时限研究案例:
注:研究的工序、考察时间点和检测项目仅供参考。
参考文献:徐晓宏,孙利民(国家药品监督管理局药品审评中心)《药品生产过程中中间产品/待包装产品存放时限的技术要求及审评考虑》