临床前研究有助于增加药物发现和开发科学家对于药物分子的认识和理解,做到知己知彼的程度,有助于使用已知活性成分更有效地开发以及配制对患者友好的剂型。前期的研究和测试有助于找到研究药物的特点和短板,有针对性的设计和解决问题,而不是带着问题去去尝试进行临床试验。监管机构对于IND的申报整体上是把决定权交给药物研发企业的,但是不代表后期的申报也是如此。
本着负责任的态度,发现问题及时解决问题;掩耳盗铃态度,对于新药开发并不可取,因为这样可能会把公司和项目带到无法回头的境地。Quick win,fast fail(速赢速败)可能更加可取。因为早期研究所花费的成本和时间远远低于新药分子后期临床试验和商业化所需的成本和花费的时间。一种新药在美国从发现到上市批准的估计开发时间通常为10-15年,平均成本为8亿至10亿美元。此外,每5000–10000个新的化学实体在研发过程中,就有大约250个新化学实体进入临床前项目,只有五个分子在临床试验中进行了实际测试,最终只有一个获得批准。现在新药开发难度在加速增加,随着带来的失败风险在不断地提高,所花费的时间和金钱也在不断地攀升。
强大的现代药物发现技术,如组合化学和高通量筛选,能够发现具有高药理活性的新化学实体NCE。这些技术也带来了新的挑战,因为许多新的候选药物具有不利的物理化学和生物药剂学特性,比如生物药剂学、药代动力学或药效学障碍,包括化学稳定性差、溶解度限制、缺乏作用位点特异性、广泛的药物代谢、通过生物屏障、利用内源性代谢途径、毒性或顺应性障碍(不可接受的味道/气味),所有这些都不利于最佳的口服生物利用度和随之而来的治疗效果。需要化学改性或使用制剂技术才能达到足够的性能并成功通过严格的药物开发审查。制剂处于CMC研发的下游,上游的筛选结果注定影响下游的开发策略,牵一发而动全身。问题出现了,对于制剂科学家的要求也提高了。
如果药物分子的物理化学性质和生物药剂学性质满足一般的开发要求,对于制剂开发和加速新药项目的临床推进,那将是百利无一害的。化学改性的策略,如前药方法,代表了解决这些障碍的潜在有效方法。
过去,前药方法曾经被认为是药物开发的最后手段; 如今不仅情况已不再如此,而且在药物研发的初始阶段就考虑了前药方法。制备前药确实意味着处理一种新的化学实体;然而,前药的成本与开发新药的成本不同。与母体药物相比,性能的提高加快了药物开发过程,最终可以节省时间、金钱和精力。
众所周知,目前新药分子比较集中的一个特性,难以溶解于生物介质中,导致药物分子难以入血,生物利用度不足,带来了一系列的问题,如药物制剂易于受到食物影响,造成病人体内的变异性;体内暴露不足,既造成药物的浪费,也可能影响药物的疗效。增溶策略是可取的,比如固体形式的优化与选择(化合物多晶型筛选,共晶,成盐,无定形形式);处方调整(加入pH调节剂,共溶剂和潜溶剂的使用以及表面活性剂);环糊精的使用制备包合物或者脂质制剂(乳剂,微乳,纳米乳,脂质体等);制备聚合物胶束;粒度降低至微米甚至纳米程度。以上策略都在化合物确定以后所采用的后发性策略,也是CMC阶段经常采用的制剂增溶策略。而采用前药策略更像是药物结构的再次优化,主动调整,当然越早越好。
药物分子的有效溶解性是制备用于药物递送的水性溶液的先决条件。此外,溶解性也是口服药物吸收过程中的关键物理化学性质之一。已经引入了两种前药方法来提高难溶性药物的溶解性:(1)通过前药衍生化降低母体药物的熔点和/或(2)向母体药物引入可电离/极性促进剂,后者是更常见的方法。化合物溶解性的增加,相应的提高化合物的生物利用度。表1中列出了最常用的可离子化和可增溶的前药结构。
表1增强难溶性药物溶解度的结构举例[2]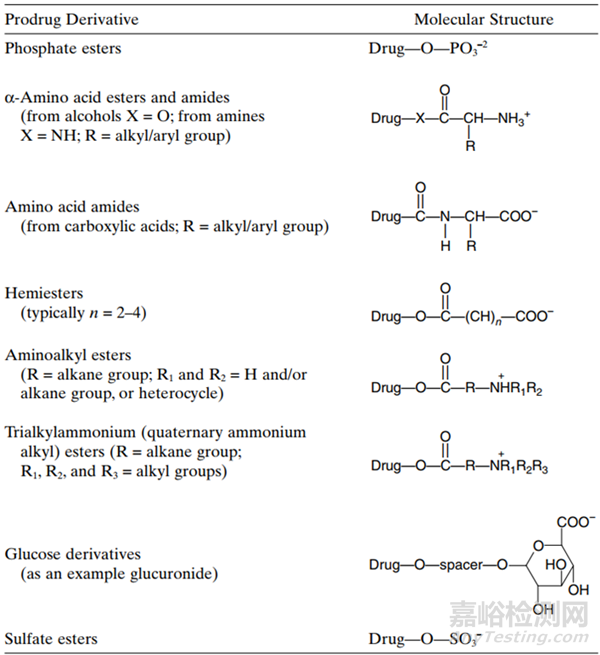
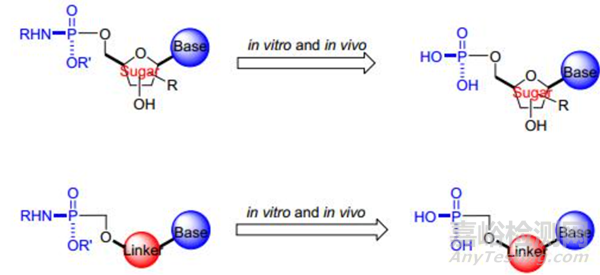
长期以来, 在化合物中引入磷酸酯或磷酸及其钠盐作为前药在药物研究与开发中是一个极其重要的策略。磷酰胺酯和磷酸酯前药是密不可分的、相互关联的一类分子, 其水解或酶解即体内代谢的产物转化为有机磷酸(图 1)和单磷酸、二磷酸或三磷酸衍生物而发挥药效。许多以注射剂型上市,而只有少数以口服剂型使用。磷酸部分可以直接或通过各种间隔基团引入到含有羟基或各种氨基官能团的母体药物分子中,在那里它相对容易地被内源性碱性磷酸酶酶切。
图1 磷酰胺酯前药转化为磷酸前药[3]
常见的基于磷酸前药策略而开发的药物。这样的前药策略主要的作用是: (1)通过改善药物的理化性质, 提高药物的传输速率和选择性; (2)提高药物的生物利用度; (3)对水溶性差的母体药物, 通过磷酸酯化提高药物的水溶性; (4)通过改变给药方式, 延长药物作用时间, 方便患者; (5)通过改善脂溶性, 提高细胞膜的穿透能力, 提高药效; (6)降低毒性, 提高治疗效果, 即提高药物的安全性。
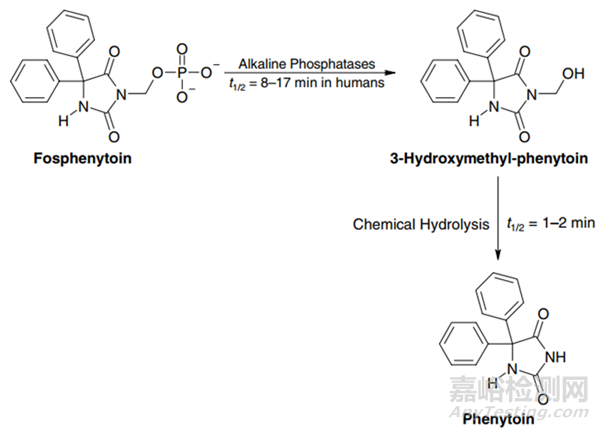
苯妥英是一种微溶性(20至25μg/mL)弱酸性(pKa=8.3)药物。相比之下,磷妥英[(苯妥英-3-基)甲基磷酸酯]是苯妥英的膦酰氧基甲基前药,具有高水溶性(140 mg/mL),在中性和微碱性pH范围内也提供良好的化学稳定性。生物转化过程涉及磷酸酶催化的去磷酸化,然后是羟甲基中间体的自发分解,最终释放母体药物(图1)。在癫痫患者中,肌肉内和静脉内给药都能使其快速、定量地生物转化为苯妥英钠,半衰期为8-17分钟。此外,肌肉内给药后的血中苯妥英水平远高于单独给药时的水平。
图2 磷苯妥英钠(Fosphenytoin)的生物转化[2]
本文我们主要是聚焦于前药的应用逻辑和具体的提高化合物溶解度上的应用,并举例说明其应用的优势。药物开发是一个团队作战的活动,一个具有优质理化和生物药剂学性质的候选化合物,对于药物开发和项目正常推进是重中之重的核心。各部门共同协同合作,不仅仅要找到具有绝对疗效的药物分子,还需要兼顾化合物性质。制剂技术在一定程度上确实可以解决一下药物分子的问题,但是其制剂开发的难度也是呈现指数级增加,如果药物发现的科学家可以在药物分子改造上在建新功,鬼斧神工般的设计,或许可以让可能“蒙尘”分子,再次焕发光芒。
参考文献
[1] Prodrugs: design and clinical applications. doi:10.1038/nrd2468.
[2]DESIGN AND PHARMACEUTICAL APPLICATIONS OF PRODRUGS. Drug Discovery Handbook, by Shayne Cox Gad.
[3]聂飚,金传飞,钟文和,等.磷酰胺酯前药策略及ProTide技术在药物研发中的应用与进展[J].有机化学, 2017, 37(11):23.DOI:10.6023/cjoc201705022.
[4] Markovi M , Ben-Shabat S , Dahan A .Prodrugs for Improved Drug Delivery: Lessons Learned from Recently Developed and Marketed Products[J].Pharmaceutics, 2020, 12(11):1031.DOI:10.3390/pharmaceutics12111031.