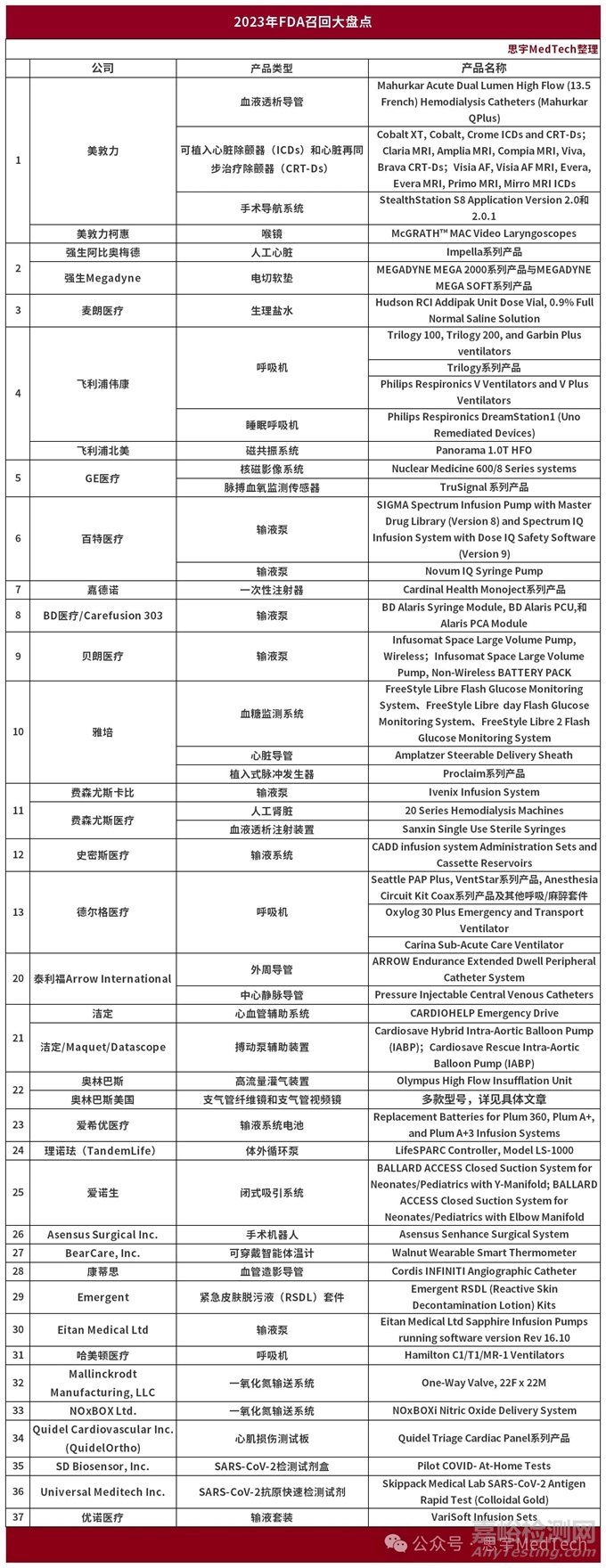
在2023年FDA发布的61篇召回通告中,涉及到37家品牌的51款产品。由于有些同类产品发了多篇通告、也有一篇通告中多个产品,按照公司整理了产品如下表。
并查询和分析了每个产品的主要缺陷,见本文第三部分。
什么是FDA召回?
FDA是负责保护公众健康的联邦机构,它通过监管食品、药品、医疗器械、化妆品等来执行这一职责。当这些产品存在潜在的安全问题或不符合法规标准时,FDA可以采取召回措施来保护消费者。
FDA根据对人体可能造成的伤害程度,将医疗器械召回分为三个等级:
I级召回:这是最严重的召回类型,用于那些可能会导致严重健康问题或死亡的情况。
II级召回:用于那些可能导致暂时性或医疗上可逆的健康问题,或者在严重性方面存在远程可能性的情况。
III级召回:用于那些不太可能对健康造成不良影响的产品。
事实上,大部分召回是厂商自愿进行的。厂商需要提供召回的原因、受影响产品的详细信息、召回措施的具体步骤以及为防止再次发生问题而采取的纠正措施。FDA会监督召回过程,确保公众得到适当的保护,并在必要时提供有关召回的信息和指导。
召回的完整流程通常包括以下几个步骤:
问题识别:厂商或FDA通过质量控制检测、消费者报告、医疗事件报告等途径发现产品存在潜在的安全问题或不符合法规标准。
风险评估:厂商需要对发现的问题进行评估,确定召回的必要性和紧迫性。这包括评估产品缺陷对公众健康的潜在风险。
通知FDA:一旦决定进行召回,厂商必须立即通知FDA,并提供召回计划。这个计划应该包括召回的原因、受影响产品的详细信息、召回的范围、召回执行的具体步骤以及预期的时间表。
公共通知:厂商通常需要发布公告,通知分销商、零售商和消费者召回的信息。这可以通过发送信件、发布网站公告或使用媒体发布等方式进行。
产品回收和纠正措施:厂商需要收回受影响的产品,并根据情况采取适当的纠正措施,例如修复、替换或退款。
状态报告:在召回过程中,厂商需要定期向FDA报告召回的进展情况,包括已收回产品的数量和采取的纠正措施。
召回终止:当FDA认为召回行动已经成功移除市场上的所有受影响产品,并且不再存在对公众健康的风险时,召回可以被终止。
后续行动:厂商可能需要采取额外的措施,例如改进生产流程、加强质量控制或重新设计产品,以防止未来发生类似的问题。
完整的说,FDA召回分为主动(自愿)和被动(强制)两类。
主动召回(自愿召回):这是最常见的召回类型,通常由生产厂商自行发起。厂商可能因为发现产品存在缺陷、不符合FDA标准或可能对消费者健康构成风险而决定自愿召回产品。主动召回需要厂商通知FDA,并按照FDA的要求执行召回计划。这种召回方式旨在迅速从市场上移除或纠正有问题的产品,以保护公众健康。
被动召回(强制召回):在极少数情况下,如果生产厂商未能自愿召回存在健康风险的产品,FDA可以发出召回令,强制厂商召回产品。这通常发生在产品被确定对人类健康构成严重且紧迫的风险时。根据21 CFR 810,FDA拥有在必要时强制召回医疗设备的权力。强制召回通常是在与厂商协商后,且认为产品有可能导致严重的不良健康后果或死亡时发起。
在实际操作中,FDA通常鼓励并倾向于与厂商合作,实施主动召回。只有在极少数情况下,当自愿召回无法实施或厂商未能采取适当行动时,FDA才会使用其强制召回的权力。
那么,厂商有可能隐瞒需要召回产品的事实么?
在某些情况下,厂商可能会试图隐瞒问题以避免召回,但这是非法的,并且会导致严重的法律后果。FDA有一系列监督和执法工具,包括检查、警告信和法律行动,以确保厂商遵守规定并采取适当的纠正措施。如果公众或医疗卫生专业人员发现产品存在问题,他们也可以向FDA报告,这有助于FDA及时了解和处理潜在的安全问题。
2023年召回整体情况分析
相对于2022年的60个召回通告,2023年的61个基本持平。
从产品类型看来,包括:
设备类:体外循环泵、血液透析导管、输液系统、核磁影像系统、呼吸机、闭式吸引系统、血糖监测系统、外周导管、电切软垫、人工心脏、可穿戴智能体温计、输液泵、呼吸机套件、SARS-CoV-2检测试剂盒、植入式心脏除颤器、心脏导管、脉搏血氧监测传感器、人工肾脏、高流量灌气装置、中心静脉导管、喉镜、搏动泵辅助装置、一氧化氮输送系统、植入式脉冲发生器、生理盐水、手术机器人、心血管辅助系统、手术导航系统、支气管显微镜和支气管视频镜、磁共振系统等。
检测试剂:包括SARS-CoV-2抗原快速检测试剂等。
其他:包括紧急皮肤脱污液套件等。
从召回原因看来,也是多种多样:
设备故障:包括软件故障、控制器故障、枢纽缺陷、管道梗阻、球螺杆故障、硅泡沫分离、Manifold开裂、非正确使用和非适配器问题、排液管泄漏、电容器泄漏、电源管理PCBA不符合标准等。
安全风险:包括包装泄漏导致效力降低、可能致严重伤害/死亡、未经FDA授权、可能存在准确性问题、使用可能导致健康风险、过热、火花或火灾风险、分配错误或重复序列号、制造缺陷导致提前关机、胶合连接制造错误、液体溶液可能被细菌污染、过热和化学物质泄漏引起皮肤刺激、灼伤、导管可能分离或泄漏、使用时可能导致儿科和成人患者烧伤、因电池耗尽可能导致停止通气、歧管止回阀错位可能导致失效、troponin水平显示不准确、SCP功能不当激活、使用该设备进行程序可能增加患者引入空气泡(空气栓塞)的风险、使用说明书未充分说明预防措施、可能在心脏除颤时降低发送到心脏的能量、升级后虚假警报可能导致治疗中断、因环境污染导致空气通道阻塞、因空气通道污染导致儿科患者潜在致癌物质接触、与推车对接错误、气囊受损、过热时设备停止治疗、PCBA通信故障、无法正确打开可能导致通风中断、患者可能无法退出MRI模式、存在流回或漏出问题等。
从召回级别看来,多数属于FDA最高级别的I类召回。
从召回时间周期看来,2023年11月和12月是召回事件高发月份,涉及了多家公司的产品。 多个召回事件在同一时期发生可能指向某一制造或监管方面的共性问题。
2023年召回全部产品回顾
以下为2023年度FDA的召回产品和召回原因(基本按公告更新时间排序):
1 Emergent
产品类型:紧急皮肤脱污液(RSDL)套件
召回产品名称:Emergent RSDL (Reactive Skin Decontamination Lotion) Kits
召回原因:包装泄漏导致效力降低,可能致严重伤害/死亡。
2 理诺珐(TandemLife)
产品类型:体外循环泵
召回产品名称:LifeSPARC Controller, Model LS-1000
召回原因:控制器软件故障,可能导致关键故障,无法静音的警报。
3 美敦力
产品类型:血液透析导管
召回产品名称:Mahurkar Acute Dual Lumen High Flow (13.5 French) Hemodialysis Catheters (Mahurkar QPlus)
召回原因:导管存在枢纽缺陷,可能导致泄漏、血液混合,影响透析效果,甚至引发出血或需手术更换。
4 史密斯医疗
产品类型:输液系统
召回产品名称:CADD infusion system Administration Sets and Cassette Reservoirs
召回原因:管道梗阻导致输液不足,虚假NDA警报阻止泵使用,可能导致患者伤害或死亡。
5 Universal Meditech Inc.
产品类型:SARS-CoV-2抗原快速检测试剂
召回产品名称:Skippack Medical Lab SARS-CoV-2 Antigen Rapid Test (Colloidal Gold)
召回原因:未经FDA授权,可能存在准确性问题,使用可能导致健康风险。
6 GE医疗
产品类型:核磁影像系统
召回产品名称:Nuclear Medicine 600/800 Series systems
召回原因:球螺杆故障和缺少安全键可能导致探测器坠落,潜在伤害或死亡。
7 飞利浦伟康
产品类型:呼吸机
召回产品名称:Trilogy 100, Trilogy 200, and Garbin Plus ventilators
召回原因:硅泡沫分离可能导致气道阻塞,呼吸困难,潜在危及生命;PE-PUR泡沫残留可能导致健康风险。
8 Avanos Medical Inc.
产品类型:闭式吸引系统
召回产品名称:BALLARD ACCESS Closed Suction System for Neonates/Pediatrics with Y-Manifold; BALLARD ACCESS Closed Suction System for Neonates/Pediatrics with Elbow Manifold
召回原因:Manifold开裂可能导致通气不足,对儿童和新生儿的患者构成严重风险。
9 雅培
产品类型:血糖监测系统
召回产品名称:FreeStyle Libre Flash Glucose Monitoring System、FreeStyle Libre 14 day Flash Glucose Monitoring System、FreeStyle Libre 2 Flash Glucose Monitoring System
召回原因:非正确使用和非Abbott适配器可能导致过热、火花或火灾,存在严重伤害或死亡风险。
10 飞利浦伟康
产品类型:睡眠呼吸机
召回产品名称:Philips Respironics DreamStation1 (Uno Remediated Devices)
召回原因:部分设备分配错误或重复序列号,可能导致错误治疗或治疗失败,存在健康危险。
11 费森尤斯卡比
产品类型:输液泵
召回产品名称:Ivenix Infusion System
召回原因:泄漏可能导致电气系统故障,治疗中断,患者可能受到严重伤害或死亡。
12 爱希优医疗
产品类型:输液系统电池
召回产品名称:Replacement Batteries for Plum 360, Plum A+, and Plum A+3 Infusion Systems
召回原因:制造缺陷导致提前关机,可能危及患者生命。
13 德尔格医疗
产品类型:呼吸机套件
召回产品名称:Seattle PAP Plus, VentStar系列产品, Anesthesia Circuit Kit Coax系列产品及其他呼吸/麻醉套件
召回原因:胶合连接制造错误可能导致呼吸回路中断,可能危及患者生命。
14 SD Biosensor, Inc.
产品类型:SARS-CoV-2检测试剂盒
召回产品名称:Pilot COVID-19 At-Home Tests
召回原因:液体溶液可能被细菌污染,可能导致感染、测试性能问题和错误结果。
15 强生 阿比奥梅徳
产品类型:人工心脏
召回产品名称:Impella 5.5 with SmartAssist
召回原因:排液管泄漏可能导致治疗中断,危及患者生命。
16 BearCare, Inc.
产品类型:可穿戴智能体温计
召回产品名称:Walnut Wearable Smart Thermometer
召回原因:过热和化学物质泄漏引起皮肤刺激、灼伤,可能导致严重伤害或死亡。
17 泰利福,及其子公司Arrow International
产品类型:外周导管
召回产品名称:ARROW Endurance Extended Dwell Peripheral Catheter System
召回原因:导管可能分离或泄漏,可能导致严重伤害,包括血管阻塞、血流不足、血栓形成、心血管事件或死亡。
18 强生Megadyne
产品类型:电切软垫
召回产品名称:MEGADYNE MEGA 2000系列产品与MEGADYNE MEGA SOFT系列产品
召回原因:使用时可能导致儿科和成人患者烧伤。
19 德尔格医疗
产品类型:呼吸机
召回产品名称:Oxylog 3000 Plus Emergency and Transport Ventilator
召回原因:因电池耗尽可能导致停止通气,存在严重伤害或死亡的风险。
20 NOxBOX Ltd.
产品类型:一氧化氮输送系统
召回产品名称:NOxBOXi Nitric Oxide Delivery System
召回原因:歧管止回阀错位可能导致失效,可能造成气体泄漏和治疗中断,对患有先天性心脏病的患者构成严重风险,可能导致严重伤害或死亡。
21 Quidel Cardiovascular Inc. (QuidelOrtho)
产品类型:心肌损伤测试板
召回产品名称:Quidel Triage Cardiac Panel系列产品
召回原因:因troponin水平显示不准确,可能导致对心肌梗死的漏诊,对患者构成严重风险,可能导致严重伤害或死亡。
22 美敦力
产品类型:可植入心脏除颤器(ICDs)和心脏再同步治疗除颤器(CRT-Ds)
召回产品名称:Cobalt XT, Cobalt, Crome ICDs and CRT-Ds;Claria MRI, Amplia MRI, Compia MRI, Viva, Brava CRT-Ds;Visia AF, Visia AF MRI, Evera, Evera MRI, Primo MRI, Mirro MRI ICDs
召回原因:SCP功能不当激活可能导致低能量输出或无能量输出,可能无法有效治疗心律失常,危及生命。
23 雅培
产品类型:心脏导管
召回产品名称:Amplatzer Steerable Delivery Sheath
召回原因:使用该设备进行程序可能增加患者引入空气泡(空气栓塞)的风险。
24 强生阿比奥梅德
产品类型:人工心脏
召回产品名称:Impella系列产品
召回原因:使用说明书未充分说明在治疗已接受经皮主动脉瓣置换(TAVR)的患者时应采取的预防措施;Impella电机外壳可能与TAVR的支架发生接触,可能损坏或摧毁电机的叶轮。
25 GE医疗
产品类型:脉搏血氧监测传感器
召回产品名称:TruSignal 系列产品
召回原因:可能在心脏除颤时降低发送到心脏的能量;受影响的传感器还可能使患者暴露于其他电流来源,或者可能提供不准确的SpO2测量结果。
26 百特医疗
产品类型:输液泵
召回产品名称:SIGMA Spectrum Infusion Pump with Master Drug Library (Version 8) and Spectrum IQ Infusion System with Dose IQ Safety Software (Version 9)
召回原因:升级后虚假警报可能导致治疗中断,威胁患者安全。
27 飞利浦伟康
产品类型:呼吸机
召回产品名称:Trilogy系列产品
召回原因:因环境污染导致空气通道阻塞,可能导致患者无法获得足够氧气,引发严重健康问题。
28 德尔格医疗
产品类型:呼吸机
召回产品名称:Carina Sub-Acute Care Ventilator
召回原因:因空气通道污染导致儿科患者潜在致癌物质接触,可能导致严重健康问题。
29 洁定/Maquet/Datascope
产品类型:搏动泵辅助装置
召回产品名称:Cardiosave Hybrid Intra-Aortic Balloon Pump (IABP);Cardiosave Rescue Intra-Aortic Balloon Pump (IABP)
召回原因:与推车对接错误;气囊受损,可能导致泵关机、氦气释放、患者失血、生物危害;因Autofill故障警报;过热时,设备停止治疗;可能因PCBA失效导致电力管理问题;PCBA通信故障;部分单位的连接显示和底座的卷缆可能失败
30 Mallinckrodt Manufacturing, LLC
产品类型:一氧化氮输送系统
召回产品名称:One-Way Valve, 22F x 22M
召回原因:无法正确打开,可能导致通风中断
31 雅培
产品类型:植入式脉冲发生器
召回产品名称:Proclaim系列产品
召回原因:患者可能无法退出MRI模式,需要Clinician Programmer进行初始编程,可能导致治疗中断。
32 麦朗医疗
产品类型:生理盐水
召回产品名称:Hudson RCI Addipak Unit Dose Vial, 0.9% Full Normal Saline Solution
召回原因:非无菌。使用可能导致呼吸问题、感染及危及生命的后果。
33 哈美顿医疗
产品类型:呼吸机
召回产品名称:Hamilton C1/T1/MR-1 Ventilators
召回原因:电容器泄漏电解液,可能导致呼吸机切换到"Ambient State";因软件问题可能导致设备停止工作,潜在造成严重后果或死亡。
34 飞利浦伟康
产品类型:呼吸机
召回产品名称:Philips Respironics V60 Ventilators and V60 Plus Ventilators
召回原因:电源管理PCBA不符合标准,使用可能导致电源故障和严重健康风险。
35 费森尤斯医疗
产品类型:人工肾脏
召回产品名称:2008 Series Hemodialysis Machines
召回原因:可能渗漏多氯联苯酸,长期使用可能导致内分泌、神经和皮肤问题。
36 奥林巴斯
产品类型:高流量灌气装置
召回产品名称:Olympus High Flow Insufflation Unit
召回原因:可能导致过度充气,引发气体栓塞、心律失常等严重健康问题。
37 泰利福和其子公司Arrow International
产品类型:中心静脉导管
召回产品名称:Pressure Injectable Central Venous Catheters
召回原因:因标签错误涉及氯己定,可能导致过敏反应,甚至死亡。
38 美敦力柯惠
产品类型:喉镜
召回产品名称:McGRATH™ MAC Video Laryngoscopes
召回原因:防止缺陷被盗设备流入市场,以避免可能导致呼吸支持不足和死亡的风险。
39 嘉德诺
产品类型:一次性注射器
召回产品名称:Cardinal Health Monoject系列产品
召回原因:防止与注射泵一起使用可能导致性能问题。
40 百特医疗
产品类型:输液泵
召回产品名称:Novum IQ Syringe Pump
召回原因:由于软件错误导致阻塞后错误指示输液已完成。
41 费森尤斯医疗
产品类型:血液透析注射装置
召回产品名称:Sanxin Single Use Sterile Syringes
召回原因:存在流回或漏出问题,可能导致血流感染、失血、肝素错误剂量等严重健康风险。
42 Asensus Surgical Inc.
产品类型:手术机器人
召回产品名称:Asensus Senhance Surgical System
召回原因:因设备故障导致辅助手术设备意外移动。
43 贝朗医疗
产品类型:输液泵
召回产品名称:Infusomat Space Large Volume Pump, Wireless;Infusomat Space Large Volume Pump, Non-Wireless BATTERY PACK
召回原因:因故障阻塞警报,可能导致高风险药物输送中断
44 优诺医疗
产品类型:输液套装
召回产品名称:VariSoft Infusion Sets
召回原因:因连接器脱落风险,可能导致胰岛素输送中断。
45 Eitan Medical Ltd
产品类型:输液泵
召回产品名称:Eitan Medical Ltd Sapphire Infusion Pumps running software version Rev 16.10
召回原因:软件版本Rev 16.10问题召回,可能导致未检测到管道中的空气,引发血管阻塞及不良健康事件。
46 BD医疗/Carefusion 303
产品类型:输液泵
召回产品名称:BD Alaris Syringe Module, BD Alaris PCU,和 Alaris PCA Module
召回原因:与Cardinal Health Monoject注射器存在兼容性问题。此问题可能导致泵操作错误,输液不准确,延迟管堵警报等潜在问题。
47 康蒂思
产品类型:血管造影导管
召回产品名称:Cordis INFINITI Angiographic Catheter
召回原因:未经适当灭菌的情况下,可能导致感染、败血症和死亡。
48 洁定
产品类型:心血管辅助系统
召回产品名称:CARDIOHELP Emergency Drive
召回原因:可能卡住或操作困难而召回。使用时可能导致患者失去足够支持,包括缺血、缺氧、中风或死亡。
49 美敦力导航
产品类型:手术导航系统
召回产品名称:StealthStation S8 Application Version 2.0和2.0.1
召回原因:可能导致手术计划数据位置偏移,不在手术区域。
50 奥林巴斯美国
产品类型:纤维支气管镜和视频支气管镜
召回产品名称:奥林巴斯纤维支气管镜和视频支气管视频镜
召回原因:存在烧伤或起火风,可能导致烧伤、呼吸困难、甚至死亡。
51 飞利浦北美
产品类型:磁共振系统
召回产品名称:Panorama 1.0T HFO
召回原因:因氦气过量压力建立在quench过程中可能导致爆炸。
如何减少召回可能性、提升产品质量和安全?
这个话题太大,区区几百字说不清楚;不同企业和产品也各有各的挑战,这里只是简单列列。
但质量,真的很重要很重要。有的医疗器械企业为了拿证快,可能会放弃或忽略过程。而质量体系和过程,是输出一个更优产品必备的;也都是年年月月的血的教训总结出来的,更是基业长青的基石。
设计阶段的策略:
采用系统工程方法:在设计阶段,采用系统工程方法可以帮助识别和管理复杂的系统需求和相互依赖性。例如,使用质量功能展开(QFD)可以帮助将顾客需求转化为具体的设计要求。
实施严格的设计控制:根据质量系统法规,实施严格的设计控制流程,包括设计输入、输出、验证和确认等步骤。例如,设计输入应该明确地描述产品的预期用途和性能要求。
进行风险管理:使用质量标准进行风险管理,识别、评估和控制设计阶段的风险。例如,通过故障模式和影响分析(FMEA)可以识别潜在的故障模式和它们对产品性能的影响。
生产过程中的策略:
加强过程控制:采用统计过程控制(SPC)和过程能力分析(CPK)等方法,监控和控制生产过程中的关键参数。例如,通过实时监控注塑成型过程的温度和压力,确保零件的一致性和质量。
实施定期设备维护:制定和执行设备维护计划,以防止设备故障导致的生产问题。例如,定期校准测量仪器,确保测量的准确性。
强化员工培训:对生产线员工进行定期培训,确保他们了解操作标准和质量要求。例如,对操作注塑机的员工进行特定的技能培训,以提高生产效率和质量。
临床前测试和后市场监测:
进行临床前测试:在产品上市前,进行严格的临床前测试,包括生物相容性测试、电气安全测试和机械强度测试等。例如,对植入式心脏起搏器进行电气安全测试,确保其在人体内的安全性能。
实施后市场监测:通过积极的后市场监测计划,收集和分析产品在市场上的性能数据。例如,通过医疗器械报告(MDR)系统收集关于产品不良事件的报告,并采取相应的纠正措施。
在医疗器械企业运营过程中,力争做到持续改进。
建立质量管理体系:根据国际标准,如ISO 13485建立和维护一个全面的质量管理体系(QMS)。这包括制定质量政策、目标、程序和记录,以及定期审查和更新这些元素以反映持续改进的成果。
采用精益生产方法:实施精益生产方法,如5S(整理、整顿、清扫、清洁、素养)、持续流动、拉动生产和价值流分析,以消除浪费、提高效率和增强产品质量。
实施六西格玛方法:采用六西格玛方法来识别和消除缺陷,通过DMAIC(定义、测量、分析、改进、控制)过程系统地改进过程和产品性能。
鼓励员工参与:鼓励员工参与改进活动,如质量圈和建议计划,以利用他们的知识和经验来识别改进机会。
进行根本原因分析:当发生问题时,进行根本原因分析(RCA)以确定问题的真正原因,并采取纠正和预防措施以防止问题再次发生。
实施变更管理:对任何影响产品质量的变更实施严格的变更管理程序,确保变更得到适当评估、批准和记录,并且所有相关人员都得到通知和培训。
定期进行内部和外部审核:定期进行内部审核以评估QMS的有效性,并采取必要的纠正措施。同时,接受外部审核,如监管机构的检查和第三方认证机构的审核,以获得客观的反馈和验证。
利用技术和数据分析:利用先进技术和数据分析工具来监控过程和产品性能,识别趋势和异常,以及支持数据驱动的决策。
展望
今天写的召回话题有点沉重。
但“败局”,也意味着新的希望。
在探索医疗器械安全性的旅程中,厂商不仅面临挑战,也拥有无限的机遇。每一次的召回事件,每一个改进的步骤,都是迈向更加安全、更加健康未来的坚实脚印。
这不是一条孤独的道路。
因为每一位研发和生产人员的努力,每一位监管机构的严格把关,以及每一位消费者的关注和反馈,都在为这个目标添砖加瓦。(也因为召回的厂商很多……别人家的召回也是自己的市场机会……)
请以积极的心态,迎接每一个改进的机会。当前不懈的努力和持续的创新,是为新一代打造出更加安全、更加可靠的医疗器械,为当前和未来的全人类的健康和福祉贡献自己的力量!