药品的生产和检验过程,应最大限度降低微生物的污染。消毒可用于设施、环境和人员等表面微生物的控制,是药品生产和检验过程中常见的降低微生物污染的控制措施。
消毒剂的效力评估是保证消毒效果的前提,是建立合理消毒规程(SOP)的重要依据。
GMP指南2023版和欧盟GMP附录1,均收载了对消毒剂验证的相关内容,USP和EN方法也有消毒剂效力验证相关介绍,这些都说明了消毒剂效力验证的重要性。
消 毒 剂 分 类
消毒剂按照对微生物的杀灭作用能力,分为:高效消毒剂、中效消毒剂、低效消毒剂。
药品生产过程中主要用的是化学消毒剂,分为:醛类、醇类、酚类、含氯消毒剂、含碘消毒剂、氧化型消毒剂、季铵盐类消毒剂、双胍类消毒剂等。
不同消毒剂对微生物的作用部位有所不同,如下表所示:
消毒剂对微生物细胞的作用部位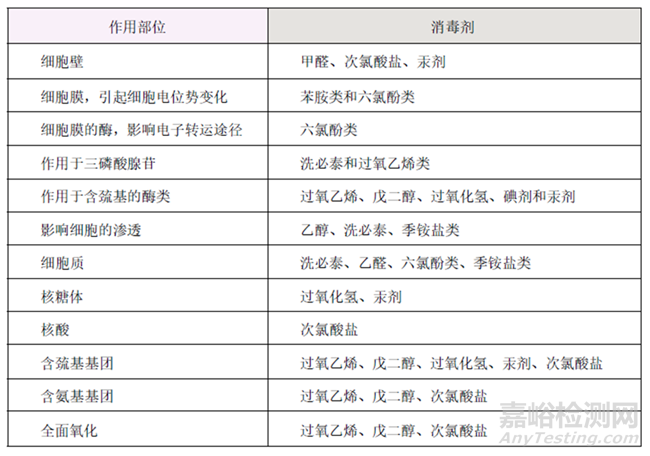
消毒剂效力验证试验内容
药企在生产过程中需要用到消毒剂,清洁和消毒操作对药品生产有直接影响。在成功完成消毒剂效力验证之后,测试实验室提供相应的文件证据,被评估的消毒剂才能在日常清洁消毒过程中被使用。
消毒剂效力验证内容包括悬液杀菌试验和载体表面杀菌试验。
1、中和剂的选择
悬液杀菌试验时需要进行中和剂筛选,常用的中和剂举例如下:
常用中和剂举例:
2、挑战微生物选择
试验使用包括细菌、酵母菌、霉菌、孢子等不同微生物,使用标准的微生物或洁净厂房中典型的环境分离菌。
试验常用的挑战微生物:
3、作用时间的选择
消毒剂验证中,杀菌时间一般选择消毒剂供应商推荐的最短作用时间的0.5倍、最短作用时间、最短作用时间的1.5倍
4、载体介质的选择
载体表面杀菌试验中需要挑选合适的表面材质,该试验用来检测消毒剂、杀孢子剂降低微生物的水平,需在不同类型的表面材质上模拟。应选择药品生产企业实际场景中具有代表性的表面材质,如最常见的表面材质、污染物易残留的多孔性载体或较难清洁的代表材料。
载体材料举例:
常 见 问 题
问:消毒剂验证的法规有哪些?
答:1、欧盟GMP附录1《无菌药品生产》中提到了污染控制策略(CCS),章节4.34中规定了消毒程序需要验证。
“4.34 The disinfection process should be validated. Validation studies should demonstrate the suitability and effectiveness of disinfectants in the specific manner in which they are used and on the type of surface material, or representative material if justified, and should support the in-use expiry periods of prepared solutions.
消毒工艺应经过验证。如经论证,验证研究应证明以特定方式使用消毒剂以及消毒剂对表面材料或代表性材料的适用性和有效性,并应支持制备溶液的使用有效期。”
2、GMP指南2023版对消毒剂验证的实施做出了指导,验证内容包含悬液杀菌试验、载体杀菌试验,同时介绍了验证微生物的选择、载体表面的选择、接触时间的选择。在2010版基础上,2023版指南新增了消毒剂供应商资质确认的章节。
问:为什么要进行消毒剂验证?可以直接使用消毒剂厂商提供的验证报告吗?
答:被选择的消毒剂在完成消毒剂效力验证之后,才能确认进行使用。消毒剂厂商为了宣称消毒剂的杀菌能力,会提供效力评估数据,这些数据通常是针对标准挑战微生物的悬液试验,不能完全代表消毒剂在实际使用过程中的杀菌能力。企业在选择消毒剂之后,需要结合实际消毒操作要求,选择合适的载体表面,进行系统的消毒剂效力验证。
问:在法规建议的基础上,如何最终确定验证需要的菌种和载体表面?
答:虽然法规没有强制要求验证的菌种和载体表面,但企业可以选择典型的标准菌株和环境监控数据库筛选的典型环境菌,同时选择厂房中代表性的载体表面,制定出适合自己的消毒剂验证方案。








