您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-05-20 08:54
一、概述
在药品实验室中,《药品GMP》是必须遵循的法规要求,而偏差管理是质量管理体系中的关键要素之一,是衡量GMP执行力的标准。 任何药品研发和生产单位都不可避免地会遇到偏差,因此偏差管理要纳入常态化质量管理。进行偏差管理有助于及时发现和上报问题,最大化减少偏差的影响范围;也有助于找出问题的根本原因,并采取针对性的纠正预防措施以避免偏差再次发生;还有助于实验室全面地进行风险评估;更有助于降低偏差调查带来的损失和成本并提高效益。简而言之,偏差管理的最终目的是为持续改进质量管理体系,提高产品质量服务。
二、法规要求
1. ICH Q7
偏差的定义:偏离批准的程序(指导文件)或制定的标准;
要求:任何偏离既定规程的情况都应当有记录并加以解释;对于重大偏差应当进行调查,并记录调查经过及其结果。
2. 中国GMP(2010年版)
第二百四十七条 各部门负责人应当确保所有人员正确执行生产工艺、质量标准、检验方法和操作规程,防止偏差的产生。
第二百四十八条 企业应当建立偏差处理的操作规程,规定偏差的报告、记录、调查、处理以及所采取的纠正措施,并有相应的记录。
第二百四十九条 任何偏差都应当评估其对产品质量的潜在影响。企业可以根据偏差的性质、范围、对产品质量潜在影响的程度将偏差分类(如重大、次要偏差),对重大偏差的评估还应当考虑是否需要对产品进行额外的检验以及对产品有效期的影响,必要时,应当对涉及重大偏差的产品进行稳定性考察。
第二百五十条 任何偏离生产工艺、物料平衡限度、质量标准、检验方法、操作规程等的情况均应当有记录,并立即报告主管人员及质量管理部门,应当有清楚的说明,重大偏差应当由质量管理部门会同其他部门进行彻底调查,并有调查报告。偏差调查报告应当由质量管理部门的指定人员审核并签字。
企业还应当采取预防措施有效防止类似偏差的再次发生。
第二百五十一条 质量管理部门应当负责偏差的分类,保存偏差调查、处理的文件和记录。
3. FDA 21 CFR
任何对成文的质量标准、标准、取样方法、检测程序或其他实验室控制机制的偏差,应作记录,并证实。
4. EU GMP
要求有完成记录并调查任何重要偏差:
1. 对重要偏差或产品、中间体等超标,应有书面调查记录,调查应延伸至与此偏差、超标相关的其他批次;
2. 任何偏差、调查及超标报告应作为批报告审核的一部分,在产品放行前予以审核。
三、偏差的分类
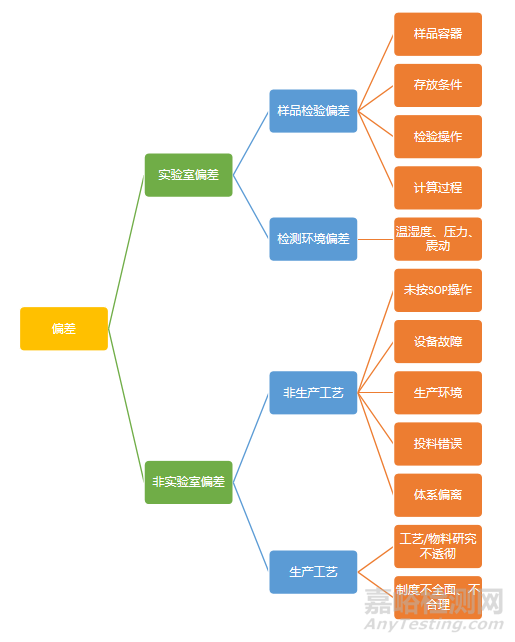
3.1 按偏差的范围分类
按偏差的范围分类,偏差可分为实验室偏差和非实验室偏差两大类,具体如下图:
3.2 按偏差的产生原因分类
偏差的产生原因分为多种,如人、机、料、法、环、抽、测、样等,具体分类见下表:
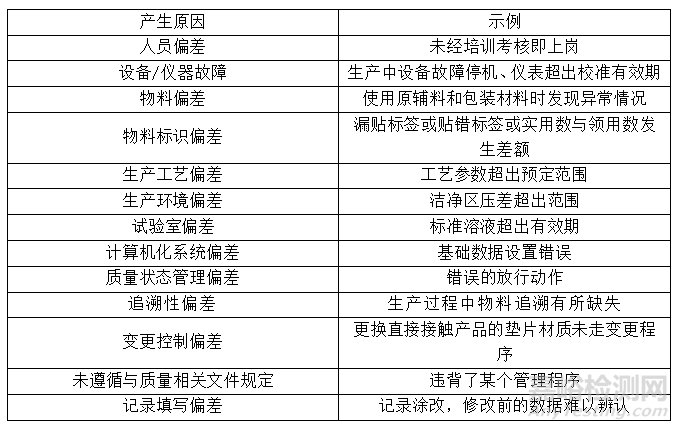
3.3 按偏差的等级分类
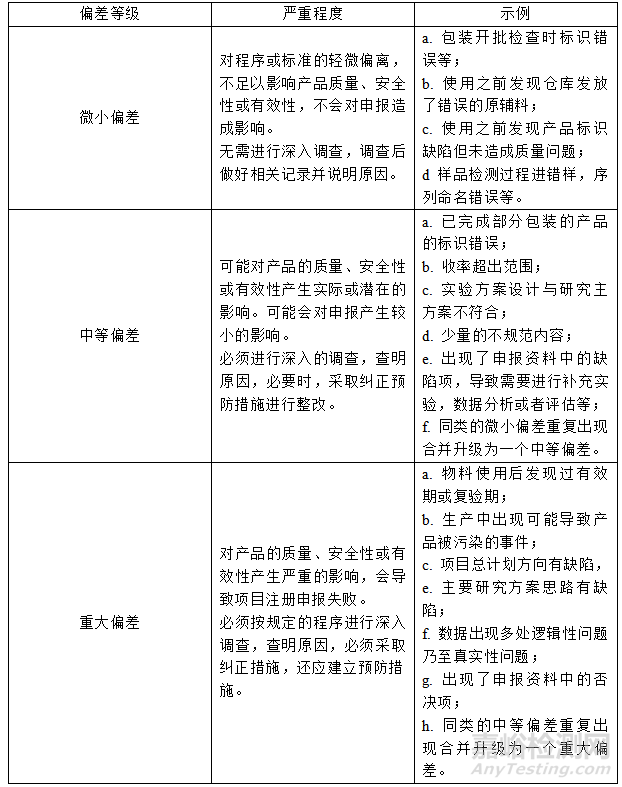
根据偏差的严重性和对产品质量的影响程度,将偏差分为三级——微小偏差、中等偏差和重大偏差,具体描述如下表:
四、偏差的管理方式
根据全生命周期管理原则,偏差适用于分阶段管理,具体的管理方式如下表。
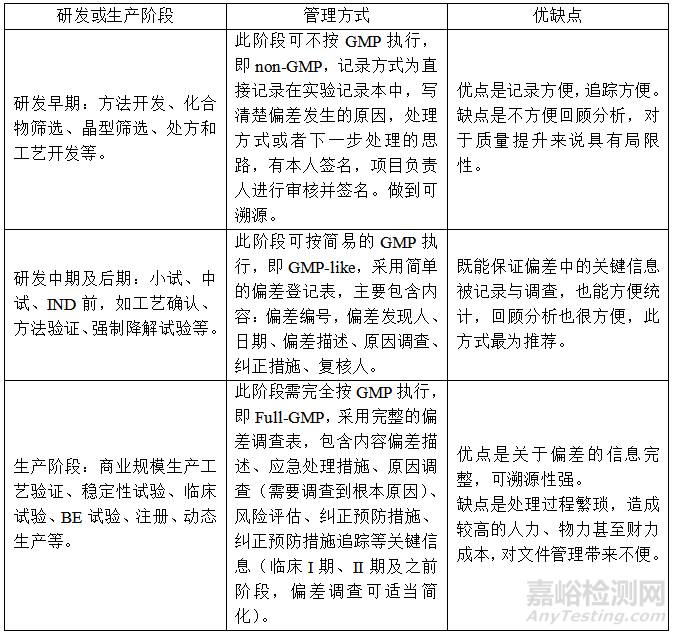
以上三种偏差管理方式分别适用于研发或生产的不同阶段,至于最适合的管理方式还应结合各单位实际情况进行具体问题具体分析。
为尽量避免同类偏差的再次出现,除了采取适当的纠正预防措施(CAPA)外,有时还需要主动出击,采取适当的变更控制措施,以确保及时、有效、持续地对质量体系进行改进,真正做到防患于未然。
五、小结
本文笔者简述了药品研发和生产过程中偏差的分类及管理方式,旨在为广大同行进行偏差报告、调查、改进等管理措施提供思路。个人建议应根据偏差的类型和研发/生产阶段采取有针对性的措施,以最大化降低成本、提高效率。对于药品实验室而言,虽然偏差会不可避免地出现,往往不期而遇,最好预防工作固然重要,但是倘若偏差来临时,每一个药品工作者更应能利用知识和经验做到兵来将挡,水来土掩,将其顺利化解!

来源:药研


