您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-03-06 09:35
摘要
目的:基于我国药品上市后变更管理框架,对变更典型问题类型和问题实例进行提炼与阐述,为药品上市许可持有人建立良好的药品上市后变更控制体系提供借鉴,也为药品上市后变更监督检查提供参考。方法:通过文献研究法,以药品管理、药品变更、药品上市后变更为关键词,检索国家药品监督管理局、国家药品监督管理局药品审评中心及各省级药品监督管理局官方网站,对我国近年来出台的系列药品变更法规进行梳理,总结我国药品变更管理框架,对2021年至2023年美国食品药品管理局警告信提出的药品变更控制缺陷进行统计与分析;通过调查研究法,基于笔者近年实际检查情况,梳理我国药品上市后变更管理的典型问题类型和问题实例。结果:我国药品变更管理框架基本完善,在国内外药品检查中发现药品上市许可持有人在药品上市后变更管理方面仍有不足,例如变更控制管理体系建立不完善,变更管理类别不恰当,未按要求进行补充申请、备案或者报告,变更未纳入变更控制管理体系,变更研究缺乏或不充分等。结论:药品上市许可持有人应建立科学合理的内部变更控制体系,开展必要的变更研究工作,并运用监管部门的沟通交流机制,就尚不确定的变更类别充分沟通;药品检查员应注重知识管理和检查经验总结,形成系统全面的变更理念,对检查过程中涉及的药品上市后变更问题进行针对性分析。
【关键词】 药品检查;药品变更;检查缺陷;变更管理;警告信
药品变更管理贯穿于药品全生命周期,以药品上市为节点,药品变更分为上市前变更与上市后变更。药品上市后变更管理是药品质量风险管理的重要内容,是国内外各类监督检查的重点之一。监管机构鼓励药品上市许可持有人(简称持有人)运用新技术、新方法、新设备、新科技成果,不断改进和优化生产工艺,持续提高药品质量,提升药品安全性、有效性和质量可控性,但不得对药品质量产生不良影响或带来潜在风险 [1]。近年来,在国内外药品检查中发现持有人在药品上市后变更管理方面仍有不足,例如变更控制管理体系建立不完善、变更管理类别不恰当、变更研究不充分等 [2-3]。因此,本文就我国药品上市后变更管理框架及常见问题进行系统分析。
1.药品变更概述
1.1 药品变更法规框架
自2019年新修订的《中华人民共和国药品管理法》颁布实施后,《药品注册管理办法》《药品生产监督管理办法》及《药品上市后变更管理办法(试行)》相继制修订并颁布实施,《药品注册申请审评期间变更工作程序(试行)》《已上市化学药品药学变更研究技术指导原则(试行)》《已上市化学药品和生物制品临床变更技术指导原则》等配套文件也陆续发布施行。浙江省、广东省、江西省等省级药品监督管理局(简称省药监局)陆续出台了本省和与上述变更文件相配套的文件,其中个别省药监局结合监管需要,进一步细化了变更情形和监管要求,例如江西省药监局于2023年6月出台《药品生产许可关键生产设施变化管理暂行规定》,将关键生产设施等条件变化实施登记管理制度,将变化情形细分为及时检查情形和纳入年度计划检查情形。至此,关于药品变更的工作程序和技术要求已基本明确,我国的药品变更法规体系基本完善,覆盖药品全生命周期的药品变更管理法规框架基本建成。部分药品变更法规文件见表1。
▲表1-部分药品变更法规文件1
注:1 仅举例部分文件;2仅是列举主要适用的变更情形,上市前、上市后变更均可参考相应法规;3《浙江省药品上市后变更管理实施细则(试行)》发布年份为 2021 年,其余文件发布年份均为 2023 年。
1.2 药品变更管理框架
以药品上市为节点,药品变更分为上市前变更与上市后变更。药品上市前变更根据注册申报阶段的不同,分为药物临床试验申请和临床试验期间的补充申请审评期间变更、药品上市许可申请审评期间的变更,变更报CDE审评审批 [5]。
《药品上市后变更管理办法(试行)》将药品上市后变更分为注册管理事项变更和生产监管事项变更。注册变更管理类别根据法律法规要求和变更对药品安全性、有效性和质量可控性可能产生影响的风险程度,分为审批类变更、备案类变更和报告类变更,生产监管事项变更分为许可事项变更和登记事项变更 [6-7]。近年来,NMPA不断优化药品上市后变更监管工作程序,2024年2月NMPA印发优化药品补充申请审评审批程序改革试点工作方案,工作方案指出,以化学药品为重点,试点省级药品监管部门按照“提前介入、一企一策、全程指导、研审联动”的原则,为辖区内药品重大变更申报前提供前置指导、核查、检验和立卷服务 [8]。
对于不需主动告知监管部门,仅需在持有人内部药品质量体系中管理和记录的变更,将其称之为质量体系类变更,例如文件体系的变更、清洁和消毒方法的变更、组织架构的变更、公用系统局部改造等,质量体系类变更是贯穿药品上市前(技术转移、工艺验证、临床用样品制备等阶段)、上市后阶段,对于这类变更会在监管机构组织的常规检查或其他检查中作为重点检查项目之一 [9-10]。药品变更管理框架见图1。

▲图1-药品变更管理框架
2.药品上市后变更常见问题
从2021-2023年中药天然药物、化学药品、生物制品补充申请的审批情况来看 [11-13],变更事项的未批准率/不通过率维持在10%左右,化学药品变更事项的未批准率/不通过率近三年普遍较高,具体见表2。已上市化学药品中等变更的典型问题主要包括备案资料不完整、变更依据不充分、研究内容不完善、变更类别不正确(如应按重大变更管理)等 [14]。化学药品生产场地变更不予备案的常见问题主要包括备案内容描述不清楚、未对关联变更进行同步研究申报、新场地包装材料和容器不合规、无菌产品验证资料不全、质量对比研究不全面、稳定性对比研究不全面等 [15]。
▲表2-2021-2023 年药品补充申请的审批情况
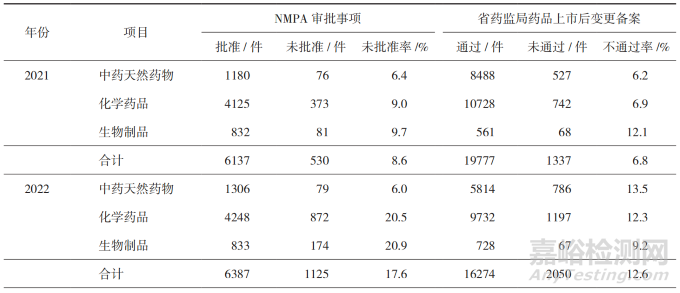
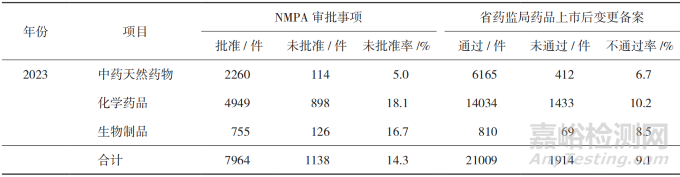
注:数据来源于 NMPA2021-2023 年药品监督管理统计年度数据 。
2.1 国外药品检查变更控制常见问题
变更控制检查缺陷在各个国家、地区药品监督检查中经常出现。在2015年至2018年世界卫生组织(World Health Organization,WHO)对我国药品生产企业检查提出的各类缺陷中,“质量控制与质量保证”部分提出的缺陷数量最多,变更控制缺陷出现的频次较高,其常见问题主要包括变更管理程序规定不科学、未基于风险进行变更控制、变更风险评估不足及措施执行不全面、未执行变更程序等 [2]。
笔者以“Current Good Manufacture Practices”为关键词检索美国食品药品管理局(Food and Drug Administration,FDA)官网的警告信(Warning Letter)数据库,梳理2021年1月至2023年12月涉及现行药品生产质量管理规范(Current Good Manufacture Practices,CGMP)检查的警告信,共计195件 [16],其中出现变更控制缺陷的警告信共40件,占比20.5%,详见表3。CGMP检查的警告信主要由FDA下设的药品审评与研究中心(Center for Drug Evaluation and Research,CDER)及监管事务办公室(Office of Regulatory Affairs,ORA)内设的药品质量运营办公室(Office of Pharmaceutical Quality Operations,OPQO)发布,其中CDER主要发布美国境外药品生产企业CGMP警告信,OPQO发布美国境内药品生产企业CGMP警告信 [17]。
▲表3-2021-2023 年 FDA CGMP 警告信情况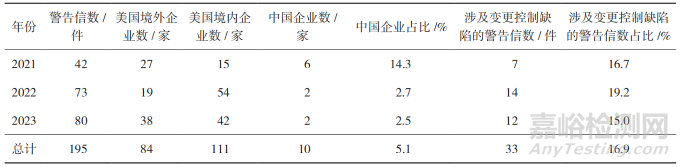
分析FDA警告信涉及的变更控制缺陷,主要包括3种问题类型。一是未建立或未能提供适当的变更控制书面程序文件,例如FDA对Spartan Chemical Company Inc、Syntec Pharma Corp等 [18-19] 多家药品生产企业发出的警告信均提到企业未建立适当的变更控制管理程序。二是未对变更进行充分确认与验证及未充分评估变更可能对产品质量的潜在影响,例如:①未在变更制剂处方前发布工艺验证方案和相关分析测试报告,支持验证方案的唯一数据来自先前处方,并不反映当前的药品处方,并自处方变更以来,已生产多批分销到美国市场的药品,工艺验证数据不足 [20];②未对变更后的美国药典的电导率检测方法进行确认,也未能评估是否由于样品制备的变更而需要额外的确认或验证 [21];③将起始物料中某杂质的可接受限度提高,未能评估该变更可能对中间体和原料药(Active Pharmaceutical Ingredient,API)质量产生的潜在影响 [22]。三是未遵循变更控制程序,变更未经质量部门的评估和批准,例如:①在没有理由或变更控制的情况下对生产过程进行了多次变更 [23];②在没有遵循变更控制程序的情况下,对消费者投诉和药品召回程序进行了变更,批准了药品标签的变更,均未按照变更控制程序的要求充分评估及记录这些变更 [24]。
2.2 国内药品检查中药品上市后变更常见问题
我国药品上市后变更主要分为注册管理事项变更、生产监管事项变更、质量管理类变更,本研究从药品检查视角出发,着眼于上述三大类变更情形,结合笔者的检查经历,分析总结其常见问题类型以及具体案例。
2.2.1 注册管理事项变更常见问题
注册管理事项变更包括药品注册批准证明文件及其附件载明的技术内容和相应管理信息的变更。根据法律法规要求和变更对药品安全性、有效性和质量可控性可能产生影响的风险程度,注册变更管理类别分为审批类变更、报告类变更和备案类变更 [6]。注册管理事项变更中的常见问题类型主要包括以下5个方面。
(1)变更管理类别不恰当。确定变更类别是变更管理工作中的关键内容之一,不同变更分类对应不同的技术要求和监管要求。持有人可根据有关技术指导原则,并结合自身管理情况制定内部变更分类原则。笔者于2022年1月至2024年6月,对国内约200家持有人(含药品生产企业)开展了调研,持有人的变更分类原则大致有3种。一是按照变更对药品安全性、有效性和质量可控性的风险和产生影响的程度以及是否影响注册,分为重大变更、中等变更和微小变更,持有人在有关技术指导原则规定的药品生产过程的重大变更、中等变更和微小变更基础上,结合自身管理情况,对自拟的重大变更、中等变更和微小变更的定义和内涵进行扩大和调整,涵盖更多情形,例如将涉及注册(经监管部门审批、备案)的变更均纳入重大变更范畴。第二种分类方式是根据变更是否影响注册,分为审批类变更、备案类变更、报告类变更和质量管理类变更。第三种是前两种分类方式共存。笔者认为持有人制定的内部变更分类可以有多样性,总的原则应是自评估的变更分类不低于法规明确的要求,并且应符合现行的技术要求和监管程序要求,即技术研究、风险评估充分,且相应的监管程序正确。具体案例:①防腐剂由苯甲酸钠变更为苯甲酸钠与苯甲酸复合使用,持有人评估为微小变更,根据《已上市中药药学变更研究技术指导原则(试行)》等文件,该变更情形应属于药品生产过程中的中等变更;②某注射液中无菌检验方法变更,持有人评估为微小变更,依据不充分。
(2)未按要求进行补充申请、备案或者报告。个别持有人存在未遵照药品上市变更法规要求,向监管机构进行补充申请、备案或者报告。这种问题常见于批准上市时间较早的品种处方工艺变更。对于此类问题,通常有两种情况,一是品种注册标准没有缺陷,企业没有严格执行标准,生产过程存在随意性。二是由于品种批准时间较早,相关研究存在历史局限性,当时核准的生产工艺或注册标准不适用当下,企业为使产品能够生产出来并符合检验要求擅自变更处方工艺。对于后一种情况,持有人应正视这个问题,不可回避,建议按照相关变更指导原则完善技术研究工作,并按照法规要求,向监管部门进行补充申请、备案或者报告。对于未按要求进行补充申请、备案或报告的行为,根据《中华人民共和国药品管理法》第一百二十四条和第一百二十七条的规定,将给予警告、罚款等行政处罚。具体案例:①某中药制剂制粒前有干燥工序,与核准的注册标准不一致;②实际加入的淀粉量超过了注册标准规定的量,未按照相关法规要求开展备案。
(3)变更未纳入变更控制管理体系。持有人变更控制流程主要包括变更的申请、评估、批准、实施、效果评价 [22]。变更申请一般由变更申请部门发起,由有经验或资质的人组成的团队对变更进行评估,评估内容主要包括评估变更的分类、变更对产品质量或对产品验证状态的潜在影响、是否对注册产生影响、需开展哪些技术研究工作等。变更必须得到质量部门及相关部门批准方可实施。变更实施后应进行效果评估,以确认变更是否已达到预期目的,变更实施应当有相应的完整记录。常见问题是持有人已按照法规要求对变更进行了补充申请、备案或报告,但未将变更纳入内部变更控制管理体系。例如已向省药监局提出增加包装规格备案,未能提供该变更的内部审核批准材料,也未纳入变更管理台账。
(4)技术研究缺乏或不充分。2021年以来,CDE陆续发布了中药制剂、化学药品、生物制品药学和临床变更指导原则以及《已上市化学药品药学变更研究技术指导原则(试行)》溶出曲线研究、原料药变更的问答等技术文件,阐述了变更研究工作的基本原则及技术要求。常见问题是持有人对于药品生产过程中的变更,特别是微小变更,技术研究内容不充分。具体案例:①前处理提取车间更换药材粉碎机组,评估为微小变更,但该变更影响评估内容不完善,未收集变更前后质量对比研究相关资料;②新增原料供应商,未对该新增供应商原料生产的首批样品进行稳定性考察。
(5)忽视关联变更。药品某一项变更往往不会独立发生的,例如批量变更往往同时伴随生产设备及生产工艺的变更,处方变更可能伴随或引发药品注册标准变更,增加规格可能会调整处方 [25]。除了药学变更的关联变更,还应关注临床变更的关联变更,例如药品注册标准变更,可关联到说明书中的执行标准项变更。具体案例:持有人变更了注册标准,注册标准编号同原标准,该变更已经质量负责人批准实施,但未修订说明书。
2.2.2 生产监管事项变更常见问题
生产监管事项变更包括药品生产许可证载明的许可事项变更和登记事项变更 [6],常见问题类型主要为登记事项未按要求进行变更登记。该方面较常见的问题是企业名称(主体不变,仅更名)、经营场所、企业负责人、生产负责人、质量负责人等登记事项信息发生变更,未按照监管要求向监管部门申请药品生产许可证变更登记。例如药品生产许可证上的企业负责人已不在岗近一年,实际已变更企业负责人,但未及时向省药监局提交变更登记。
2.2.3 质量管理类变更常见问题
质量管理类变更不需主动告知监管部门,依靠内部变更控制程序,变更内容涉及药品生产质量方面,对应《药品生产质量管理规范(2010年修订)》的章节,主要涵盖机构与人员、厂房与设施、设备、物料与产品、文件管理、生产管理、质量控制与质量保证、委托生产与委托检验等方面内容 [26]。质量管理类变更常见问题类型主要包括以下3个方面。
(1)未纳入变更控制体系,未记录变更。这类问题常见的是未将设备变更,新增原辅料、包装材料供应商及变更包装标签样式(不改变内容)等情况纳入变更管理。具体案例:①口服固体制剂车间增加干法制粒机、方锥混合机设备及增加纯化水用水点,均未登记在当年变更台账中;②新增某原料药的经销商,但无相应的变更记录;③某颗粒外包装小盒的 [产品批号]、[生产日期]、[有效期至] 打印处底色由无底色改成黑色,未对该变更进行记录。
(2)未开展评估、确认、验证及相关研究工作。常见问题主要包括设备变更未进行设备确认,检验方法变更未进行验证或确认,变更生产工艺参数未进行相关验证等。具体案例:①固体制剂车间胶囊填充间新增加了一台全自动胶囊剂检重机,按照《变更控制管理规程》的要求提出了变更申请,但未对新增设备对产品质量的潜在影响进行评估和分析,未进行设备确认;②企业的医用氧标准根据NMPA修订件(批件号:XGB2021-061)进行了变更,制定了医用氧成品质量标准,但无方法确认记录;③企业根据《中华人民共和国药典》2020年版制法变更了酒黄精的工艺规程,但未进行工艺验证即开展商业化生产。
(3)文件变更管理不规范。除以上两种常见问题类型外,还有一类问题需关注,即文件变更,常见问题主要包括变更控制管理程序未根据NMPA发布的变更法规进行更新,以及变更管理程序设定不合理,文件变更未纳入变更控制体系,变更实施前相关文件未修订生效等。具体案例:①持有人《变更控制管理规程》未依据2021年NMPA发布的《药品上市后变更管理办法(试行)》及有关技术指导原则对相应的变更管理规程进行修订;②持有人《变更控制管理制度》列举的变更情形仅包括药学变更,未包括生产监管事项变更、临床变更、关键设施变化等情形;③某乳剂申请增加生产批量(微小变更),经3批工艺验证后,质量负责人审批同意新增生产批量,但相应工艺规程未修订。
3.结论与建议
我国药品变更管理框架基本完善,持有人在药品上市后变更管理方面仍有不足。持有人承担药品全生命周期的质量安全主体责任,是药品上市后变更管理的责任主体。对于持有人的药品上市后变更管理,笔者有如下几点建议。(1)持有人应在充分学习、理解药品变更法规基础上,建立科学合理的内部变更控制体系,制定完善的药品变更控制管理程序文件,制定符合法规要求并满足内部管理需求的内部变更分类原则,变更事项内容不仅应涵盖生产监管事项、注册管理事项,还应包括质量管理类变更。(2)应开展充分的变更研究工作,充分学习中药制剂、化学药品、生物制品药学和临床变更指导原则以及《已上市化学药品药学变更研究技术指导原则(试行)》溶出曲线研究、原料药变更的问答等技术文件,掌握变更研究的技术要求。(3)充分运用监管部门的沟通交流机制,对于尚不确定的变更分类,建议提前与药品监管部门沟通交流,并定期收集CDE、各省级药品监管部门公布的关于变更管理的共性问题解答。
药品检查是监管部门保证药品质量的重要监管措施,是发现持有人药品上市后变更问题的重要手段。药品检查员应注重知识管理和检查经验总结,形成系统全面的变更理念,对检查过程中涉及的药品上市后变更问题进行针对性分析,避免“一刀切”现象的出现。总之,持有人与监管部门均应懂得运用风险管理理念,深刻认识变更对产品质量的潜在影响,加强变更管理,确保药品质量。
参考文献
[1] 吴凡,廖辉军,梅蕾蕾,等 . 我国药品检查过程中上市后变更风险的研究与控制 [J]. 药品评价,2021,18(24):1481-1486.
[2] 颜若曦,曹轶,李小春 . 世界卫生组织药品检查分析[J]. 中国药物评价,2020,37(1):61-65.
[3] 漆亮,洪玲洁,宋宇 . 江西省 2022 年度药品 GMP 检查缺陷分析与研究 [J]. 药品评价,2023,20(11):1301-1305.
[4] 江西省药品监督管理局 . 关于印发《江西省药品监督管理局药品生产许可关键生产设施变化管理暂行规 定》 的 通 知 [EB/OL].(2023-06-29)[2024-0618].
[5] 国家药品监督管理局药品审评中心 . 国家药监局药审中心关于发布《药品注册申请审评期间变更工作程序(试行)》的通知(药审业〔2022〕597 号) [EB/OL].(2022-11-11)[2024-06-18].
https://www.cde.org.cn/main/news/viewInfoCommon/0d5a8825b3da3461f93de60674100111.
[6] 国家药品监督管理局 . 药品上市后变更管理办法(试行)[EB/OL].(2021-01-13)[2024-06-18].
https://www.nmpa.gov.cn/xxgk/fgwj/xzhgfxwj/20210113142301136.html.
[7] 国家市场监督管理总局 . 药品生产监督管理办法 [EB/OL].(2020-01-22)[2024-06-18].
https://www.gov.cn/gongbao/content/2020/content_5515280.htm.
[8] 国家药品监督管理局 . 国家药监局关于印发优化药品补充申请审评审批程序改革试点工作方案的通知 [EB/OL].(2024-02-07)[2024-06-18].
https://www.nmpa.gov.cn/xxgk/fgwj/gzwj/gzwjyp/20240207173908137.html.
[9] ICH. Q12:药品生命周期管理的技术和监管考虑 [EB/OL].(2019-11-20)[2024-06-18].
https://www.cde.org.cn/ichWeb/news/getNewsDetail/2/bb27c3d90c540d64d269e6c9da9db061/1.
[10] 国家药品监督管理局 . 国家药监局关于发布《药品生产质量管理规范(2010 年修订)》临床试验用药品附录的公告(2022 年第 43 号)[EB/OL].(2022-05-27)[2024-06-18].
https://www.nmpa.gov.cn/xxgk/fgwj/xzhgfxwj/20220527182006196.html.
[11]国 家 药 品 监 督 管 理 局 . 药品监督管理统计年度数据(2021 年)[EB/OL].(2022-12-28)[2024-06-18].
https://www.nmpa.gov.cn/directory/web/nmpa/zwgk/tjxx/tjnb/20221228165838115.html.
[12] 国家药品监督管理局 . 药品监督管理统计年度数据(2022 年)[EB/OL].(2023-04-19)[2024-06-18].
https://www.nmpa.gov.cn/zwgk/tjxx/tjnb/20230419090931121.html.
[13] 国家药品监督管理局 . 药品监督管理统计年度数据(2023 年)[EB/OL].(2024-05-20)[2024-06-18]. https://www.nmpa.gov.cn/zwgk/tjxx/tjnb/20240520160659160.html.
[14] 袁建龙,张灵娜,陈晴宇,等 . 已上市化学药品中等变更的典型问题分析 [J]. 中国医药工业杂志,2023,54(10):1517-1520.
[15] 武海军,周冲,刘福龙,等 . 上市后化学药品制剂生产场地变更政策解读与常见问题分析 [J]. 中国药学杂志,2023,58(1):83-86.
[16] FDA. Warning Letters [EB/OL]. [2024-06-18].
https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/compliance-actions-and-activities/warning-letters.
[17] 程立 . 美国 FDA 警告信制度对我国药品监管工作的启示 [J]. 行政科学论坛,2022,9(8):47-50.
[18] FDA. Warning Letter: Spartan Chemical Company,Inc.[EB/OL].(2021-12-28)[2024-06-18].
https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/warning-letters/spartan-chemical-company-inc-614450-12152021.
[19] FDA.Warning Letter: Syntec Pharma Corp[EB/OL].(2021-08-03).[2024-06-18].
https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/warning-letters/syntec-pharma-corp-612765-07062021.
[20] FDA.Warning Letter: Health Plus Inc[EB/OL].(2022-01-25)[2024-06-18].
https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/warning-letters/health-plus-inc-616877-12292021.
[21] FDA.Warning Letter: DuPont Nutrition USA Inc[EB/OL].(2022-12-20)[2024-06-18].
https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/warning-letters/dupont-nutrition-usa-inc-627211-12022022.
[22] FDA.Warning Letter: Aurobindo Pharmaceutical [EB/OL].(2022-01-25)[2024-06-18].
Limitedhttps://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/warning-letters/aurobindo-pharmaceutical-limited-618091-01122022.
[23] FDA.Warning Letter: Premier Trends LLC [EB/OL].(2022-03-22)[2024-06-18].
https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/warning-lettes/premier-trends-llc-621313-03142022.
[24] FDA.Warning Letter: Sircle Laboratories LLC[EB/OL].(2021-10-19)[2024-06-18].
https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/warning-lettes/sircle-laboratories-llc-615098-09212021.
[25] 国家药品监督管理局药品审评中心 . 已上市化学药品药学变更研究技术指导原则(试行) [EB/OL].(2021-02-10)[2024-06-18].
https://www.cde.org.cn/main/news/viewInfoCommon/4ec3dca752a82347bdf24ad3d3e85113.
[26] 中华人民共和国卫生部 . 药品生产质量管理规范 [EB/OL].(2011-01-17)[2024-06-18]. https://www.samr.gov.cn/zw/zfxxgk/fdzdgknr/bgt/art/2023/art_d5e1dbaa8f284277a5f6c3e2fc840d00.html.

来源:中国知网


