您当前的位置:检测资讯 > 监管召回
嘉峪检测网 2024-05-28 08:22
继今年2月向公众发出警告后,FDA再一次升级了其对Hologic(豪洛捷)的乳腺癌手术植入BioZorb标记物和BioZorb小型标记物并发症相关的安全警告。
在收到71份患者受伤报告后,5月22号,FDA再次发布警告,并对该问题发布了一级召回标签,这是该机构最严重的认定。
BioZorb植入物是专注于妇科肿瘤筛查、影像和微创手术等细分领域的豪洛捷公司于2018年底通过1.25亿美元收购Focal Therapeutics所获得的植入产品。BioZorb标记物和 BioZorb小型标记物是可植入放射学标记物,用于标记软组织位点,包括乳腺组织,方便日后进行放射治疗等医疗程序。BioZorb标记物和BioZorb小型标记物有两个组件:一个为可吸收塑料组件,可在一年或更长时间内被患者身体完全吸收;另一个为钛金属组件,具有永久性。
在Hologic营销材料中,包括一位外科医生使用BioZorb的球形来“支持组织愈合和乳房轮廓”的描述,并强调“我们证明了植入后2年和3年的轮廓没有变化”。然而,FDA在其通知中强调,该设备尚未被批准用于“填充组织空间或改善手术后的美容效果”。
在今年2月,FDA就收到了相关不良反应的报告,报告描述了在乳腺组织中使用BioZorb标记物和BioZorb小型标记物时出现的并发症,包括感染、积液(血清肿)、器械位移、器械穿透皮肤、疼痛、不适、皮疹等。FDA表示,一些患者需要额外的手术来移除植入物,而且某些并发症“可能与吸收时间延长有关”,因为BioZorb的线圈需要几年的时间才能溶解。
Hologic在3月中旬向客户发出了说明书,告诉患者如果遇到任何副作用,请联系他们的医生,并且临床医生应该在进行任何乳腺癌手术或保乳手术之前讨论植入式标记物的风险。
但随着受害人数的上升,FDA及Hologic公司对旗下BioZorb标记物和BioZorb小型标记物九个型号共计5.3万台的设备进行了召回。
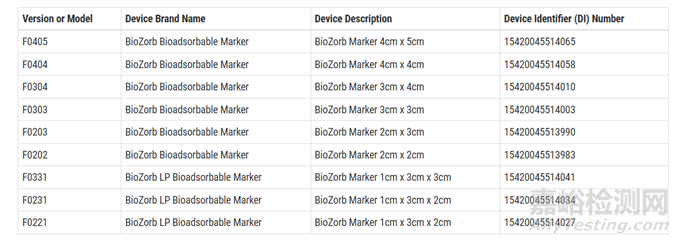
图片来源:FDA
据该公司和FDA称,该通知不要求将任何硬件退还给制造商,这些硬件可能会继续使用。
参考资料:
FDA网站
Fierce Biotech
公司公告及PDF文件

来源:一度医药


