您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-05-28 09:10
2024年5月24日,微创血管内介入磁导航手术机器人公司Stereotaxis (NYSE:STXSW)宣布,已经获得欧盟新医疗器械法规 (MDR) 监管框架下的CE标志重新认证。
MDR框架下的重新认证涵盖目前Stereotaxis在欧洲提供的所有设备。
什么是MDR认证
MDR全称是“Medical devices Regulation”, 特指欧盟医疗器械法规“Regulation (EU) 2017/745”。
所谓MDR认证,即指出口到欧盟的医疗器械CE认证,是医疗器械市场准入的必备要求之一,是欧盟新的医疗器械监管法规。
该认证要求通过对医疗器械的安全性和有效性进行评估,确保符合欧洲市场的质量标准和法律法规要求,保护公众健康和患者安全。
MDR于2017年5月26日正式生效,并于2020年5月26日期正式取代MDD(93/42/EEC)和AIMD(90/385/EEC)。
自申请之日起,所有在欧盟市场上新投放市场的医疗设备都必须符合MDR的要求。
MDR实施之后,在三年过渡期内仍然可以按照MDD和AIMDD申请CE证书并保持有效性。
依据Article 120 clause 2的规定,过渡期内签发的CE证书继续有效,但是从其交付日期起有效期不超过5年,并且于2024年5月27日失效。
然而,目前仍有相当一部分制造商未能及时根据新的欧盟医疗器械法规(MDR)和体外诊断医疗器械法规(IVDR)完成其产品的合规性过渡,尤其如果他们不能在截止日期2024年5月26日之前完成的话,这将会导致产品被迫退出欧盟市场。
MDR认证特点
实际上,MDR认证是一个需要专业技能和经验的复杂过程,需要各个方面协调合作,完成一系列的工作任务,主要涵盖以下内容:
风险管理:MDR对高风险类别的医疗器械有更加严格的要求,进行更全面的评估和审查;
技术文件要求:制造商需要准备详细的技术文件,包括产品的设计和规格、性能评估、临床评估、质量管理体系等信息;
设计和制造:医疗器械的设计、材料、制造工艺等的验证和确认;
生物相容性:医疗器械使用前需要进行生物学测试,评估对人体生物学系统的影响,这些测试包括细胞毒性、致敏性、皮肤刺激性、植入材料等;
物理和机械性能:进行物理和机械性能测试,以评估其在使用过程中的性能和安全性,这些测试可以包括电气安全、机械安全、防水防尘、落地冲击、振动等;
软件验证:对于有软件控制的医疗器械,需要进行软件验证;
标签和说明:医疗器械的标签和说明需要符合MDR要求,以确保用户可以正确、安全地使用医疗器械;
包装验证:医疗器械的包装需要进行验证,以确保能够保护医疗器械在运输和存储中不受损害,并能提供正确的使用说明和警告信息;
临床评估:医疗器械需要进行全面的临床评估,以评估其安全性和性能。在某些情况下,还需要进行临床试验,以获得更充分的临床数据。
高管评价
董事长兼首席执行官 David Fischel 表示:
“我们的产品和质量体系获得 MDR 认证的最后一步是 Stereotaxis 团队多年辛勤工作的结晶,感谢有关机构的合作。这也反映了 Stereotaxis 对高质量设备、系统和流程的承诺,确保为患者和医生提供最佳体验。”
Stereotaxis 产品速览
全球首个磁导航电生理机器人Niobe
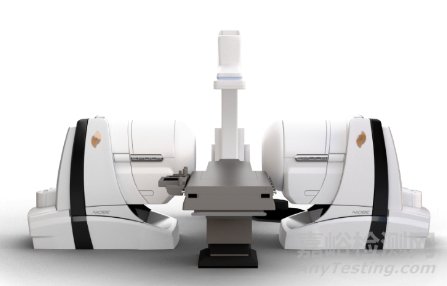
在手术过程中,医生使用直观的计算机界面来调整患者周围的磁场。这使医生能够精确地引导和操纵在其尖端嵌入磁铁的导管。
该系统能够降低医生和患者在RCFA手术过程中受到的辐射,同时提高柔性磁导管插入的安全性和准确性。
2020年升级版Genesis RMN系统获得美国FDA上市批准。

Genesis RMN利用较小的磁铁,沿着其质心旋转。在导航程序中,Genesis RMN System比Stereotaxis Niobe快70%到80%。
Genesis RMN采用了比Niobe小46%的磁体,并更新了磁体的操纵方式。磁体沿其质心旋转,能及时响应医生的操纵,响应速度比Niobe快了70% - 80%。
Odyssey系统
Odyssey 解决方案包括用于电生理(EP)信息管理的Odyssey Vision和Odyssey Cinema产品。
Odyssey Vision是一个可在单个显示器中整合患者信息的显示器系统;
Odyssey Cinema支持全球各地的电脑实时远程查看手术实况和录制影像,彻底改变了在全球范围内提供远程指导和教育的方式。
Stereotaxis 最新动态
2024年,Stereotaxis公司最近提交了其磁介入消融导管(MAGiC)以获得欧洲和美国监管机构的批准。
MAGiC 是一种机器人导航磁消融导管,设计用于执行微创心脏消融手术。正式测试进展顺利,大部分测试已成功完成。预计将在年中获得CE批准,在下半年获得FDA批准。
2024年5月14日,Stereotaxis公司宣布收购电生理导管生产公司Acccess Point Technology (APT),进军电生理消融耗材领域。
MDR法规的目标
提高医疗器械的质量、安全性和可靠性
对植入物等高风险器械实施更严格的控制,要求在将器械投放市场之前,需要咨询欧盟层面的专家。
确保重要信息易于查找
例如,将为患者引入带有所有植入物相关重要信息的植入卡,并且每个产品都必须有一个唯一的器械标识符,以便可以在新的欧洲医疗器械数据库 (EUDAMED) 中找到它。
加强市场监控
一旦器械进入欧盟市场,制造商将有义务收集有关其性能的数据,欧盟国家将在市场监控领域进行更密切的协调。
关于Stereotaxis

Stereotaxis成立于1990年,是电生理创新机器人技术的全球领导者,致力于为介入导管室提供可应用于电生理等介入手术的机器人系统及配套解决方案,帮助医生为患者提供更高精确度和安全性的手术治疗,并提高导管室手术效率以及加强手术信息的整合。
Stereotaxis于2003年推出了全球首个磁导航电生理机器人Niobe,升级版Genesis RMN系统于2020年获得了美国FDA上市批准。
Stereotaxis研发的电生理机器人系统的核心组件还在中国、日本、欧盟、加拿大等国家和地区获得了注册批准。
截至 2024 年 3 月 31 日的第一季度,收入同比增长 5% 至 690 万美元。亏损与去年同期相比略有收窄。Stereotaxis 本季度末拥有 1820 万美元现金和现金等价物,且无债务。

来源:MedRobot


