您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-06-08 18:56
Geron公司日前宣布,美国FDA已批准其“first-in-class”端粒酶抑制剂Rytelo(imetelstat)用于治疗患有低风险至中等-1风险的骨髓增生异常综合征(MDS)成年患者,这些患者患有输血依赖性贫血,需要8周内输入4个或更多的红细胞单位,且患者对红细胞生成刺激剂(ESAs)无应答或产生耐药,或不适合使用ESAs。根据新闻稿,Rytelo是首个获美国FDA批准的端粒酶抑制剂。自1984年端粒酶被发现以来,经过近40年的等待,产业界终于迎来首款端粒酶靶向疗法。Rytelo被行业媒体Evaluate列为今年10大潜在重磅疗法之一。
低风险骨髓增生异常综合征(LR-MDS)是一种血癌,随着疾病发展,患者会需要包含在贫血、疲劳等关键症状上逐渐强化的控制,这使得LR-MDS患者经常变得依赖红细胞输血,进而导致其生活质量降低与生存期的缩短。对于ESA治疗失败患者,现有治疗方案仅限于特定亚群,因此临床上对于能够提供持续、长期红细胞输血独立的疗法存在未满足的需求。
美国FDA批准Rytelo主要是基于IMerge临床3期试验的积极结果。IMerge试验达到其主要终点和关键次要终点。与安慰剂相比,Rytelo至少连续8周(Rytelo:39.8%,95% CI:30.9–49.3;安慰剂:15.0%,95% CI:7.1–26.6;p<0.001)和至少24周(Rytelo:28.0%,95% CI:20.1-37.0;安慰剂:3.3%,95% CI:0.4-11.5;p<0.001)显示出显著更高的红细胞输血独立性(RBC-TI)。RBC-TI在接受Rytelo治疗的患者中持久维持,8周应答者和24周应答者的RBC-TI中位持续时间分别约为1年和1.5年。试验详细结果发布于《柳叶刀》杂志。
在对接受Rytelo治疗并达到≥8周RBC-TI患者的探索性分析中,Rytelo组血红蛋白中位增幅为3.6 g/dL,安慰剂组为0.8 g/dL。在关键MDS亚组中均观察到具有临床意义的疗效结果,无论患者的环状铁粒幼细胞(RS)状态、基线输血负担和国际预后评分系统(IPSS)风险类别如何。
在IMerge试验中,Rytelo展现良好的安全性特征,患者出现的血小板减少症和中性粒细胞减少症通常可控制且持续时间短。
Rytelo是一款"first-in-class"寡核苷酸端粒酶抑制剂。端粒是染色体末端的保护帽,每次细胞分裂时都会自然缩短。在LR-MDS中,异常骨髓细胞通常表达端粒酶,端粒酶会重建端粒,从而导致不受控制的细胞分裂。临床前和临床试验数据显示,Rytelo通过抑制端粒酶活性,可以抑制癌变干细胞和祖细胞不可控制的增殖,导致癌变细胞的凋亡,具有改变疾病进程的活性。今年3月,美国FDA肿瘤学药物咨询委员会(ODAC)以12比2的投票结果,支持Rytelo用于治疗对ESAs无应答或产生耐药,或无法接受ESAs的输血依赖性贫血成年患者。
除了Rytelo,目前全球有多款同样靶向端粒酶的在研药品处于临床前与临床阶段,分别针对不同适应症:
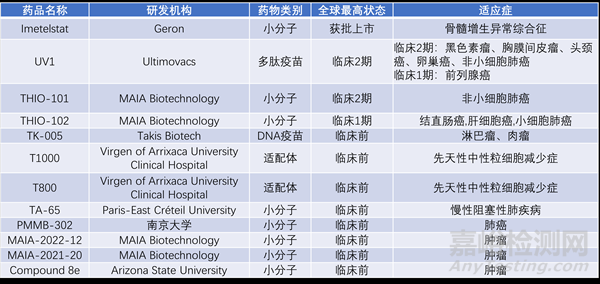
▲截至2024年6月7日,全球处于活跃研发状态的端粒酶靶向疗法盘点
参考资料:
[1] Geron Announces FDA Approval of RYTELO™ (imetelstat), a First-in-Class Telomerase Inhibitor, for the Treatment of Adult Patients with Lower-Risk MDS with Transfusion-Dependent Anemia. Retrieved June 7, 2024 from https://www.businesswire.com/news/home/20240606850162/en
[2] Press release. Retrieved June 7, 2024 from https://www.nobelprize.org/prizes/medicine/2009/press-release/#:~:text=On%20Christmas%20Day%2C%201984%2C%20Greider,to%20contain%20the%20CCCCAA%20sequence.

来源:药明康德


