您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-07-15 09:07
一、注册起始物料(RSM)的法规层面基本考量
注册起始原料(Registering Starting Material)既是原料药注册申请通用技术文件(CTD格式)中工艺描述的出发点,也是药品生产质量管理规范(GMP)第一次实施的引入点,还是今后药品生命周期管理的起始点。对于化学合成原料药而言,起始原料的选择是一个首要的问题,也是原料药药学(CMC)审评部分的重点及难点。
起始原料的选择若不被监管机构所接受,将可能严重影响原料药的审评进程。若最终重新定义起始原料,将拟定的申报工艺前移,原拟定的起始原料作为更新后申报路线的GMP中间体,则需要重新提供新拟定的起始原料相关信息,包括但不限于制备路线(如,详细的工艺流程图)、质量标准及质量研究等,还需要根据对生产工艺的研究及理解,评估原制订的原料药控制策略,比如有关物质(有机杂质、无机杂质、残留溶剂、元素杂质、潜在致突变性杂质等),在新拟定的起始原料基础条件下是否需要进行相应的调整。
申请人在选择和论证起始原料时应当综合考虑所有的ICH Q11 原则,而不是只选择使用少数几个原则来论证起始原料。如果所选起始原料不符合所有的基本原则,则应该给出合理解释说明,同时提供相应的合理论据,以说明拟定的该起始原料是合适的。
在ICH Q11 中所述的“起始原料”与ICH Q7 中所述的“原料药起始原料”没有差异。ICH Q11 选择起始原料的基本原则适用于线性和汇聚式合成起始原料的选择。ICH Q11 选择起始原料的基本原则适用于发生多个化学变化但没有分离出中间体的工艺,未分离的中间体通常不被考虑作为合适的起始原料。
ICH Q11 明确指出了市售化学品和定制合成化学品之间的区别。ICH Q11 声明“市售化学品通常是指除了拟定用作起始原料外,作为已存在的、有非药用市场进行销售的商品”。“非药用市场”是为了排除那些声称作为市售化学品的中间体。ICH Q11并未给出“定制合成化学品”的定义,但是定制合成化学品通常理解为某个原料药生产商的需求而特别生产定制的,可以是自制或者外包生产,或者是可供购买但只用于药物生产。如果使用市售化学品作为起始原料,申请人通常不需要论证,而如果使用了定制合成化学品作为起始原料,则需要根据ICH Q11 基本原则进行合理性的论证。
与此同时,对于外购的起始原料,需要提供起始原料生产商出具的制备工艺(包含工艺描述及其工艺流程图、生产过程使用的溶剂试剂等相关证明性文件),并根据相关技术指导原则、技术审评要求对杂质进行全面的分析和控制,制订合理的质量标准,并充分论述质量标准(尤其是常规的重点关注检测项:如有关物质、含量、对映异构体等)的制定依据,并提供代表性批次起始原料的检测数据、放行报告及相关图谱等。同时对所有申报的起始原料应制定供应商审计计划,并提供审计报告(上市批准前的核查批次使用*)。
*PAI(上市批准前核查),目前国内创新药的常规模式有二合一(即注册核查与GMP符合性检查一同进行)、注册核查与GMP符合性检查分开进行。注:注册核查由CFDI负责,GMP符合性检查由省局主导开展。
二、注册起始物料(RSM)质量控制的基本要求
在ICH Q11中明确了以下几点质量控制及管理的基本要求:
1.明确了杂质含量水平对原料药杂质谱有影响的定义,以及ICH Q11例4中“持续存在”杂质的定义。说明对于工艺上游中早期形成的,经多步步骤后仍“持续存在”的杂质,可以基于一定的科学认知和风险评估,制订相应的控制策略,并非必需将此杂质的形成步骤纳入起始物料的申报工艺中。
2.明确了如何确定哪些工艺步骤会影响原料药的致突变性杂质谱。同时,并不建议将涉及致突变性杂质的所有步骤、或涉及区域选择性/立体选择性的所有步骤均包括在起始物料的申报工艺描述中。
3.明确了评估是否包括足够工艺步骤所应考虑的事项,同时建议应保证在GMP条件下能有足够的工艺步骤,以降低潜在交叉污染或以后起始原料相应变更(如,合成路线、供应商)所带来的潜在风险。
三、注册起始物料(RSM)选择依据的主要论述点
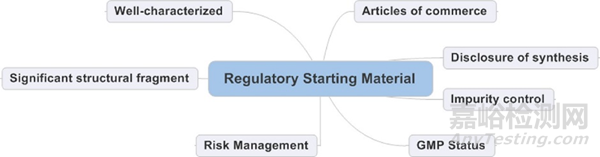
● 起始物料为原料药结构的重要组成片段,且经过了一定的分离纯化工序,同时起始物料必须具备明确的化学特性和结构,且物料通常较稳定。
● 起始物料的上游步骤不影响原料药的杂质谱(除了含有某个持续存在杂质以外)。
● 起始物料的杂质谱已明晰,杂质的转化与清除环节均已明确且制定了相应的控制策略。
● 起始物料建立了有效的分析检测方法,具有良好的杂质检测分离能力,确保起始物料的质量,从而不影响原料药的质量。
● 完成外购起始物料供应商的质量审计,以保证供应商的起始物料对原料药质量的影响始终处于较可控的状态。
四、注册起始物料(RSM)评估工具及应用简述
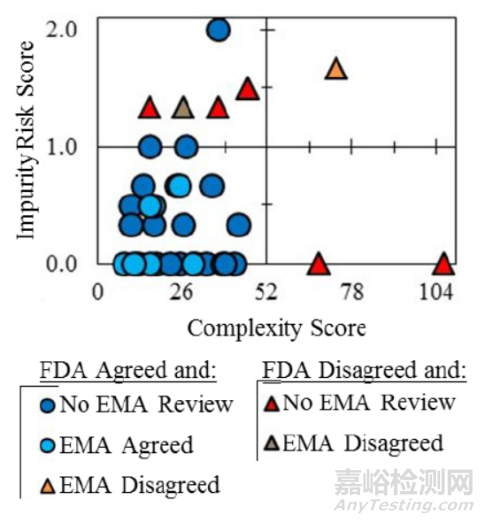
2017年Wigman等人Roche、Genentech和 Chugai Pharmaceutical 首次发布风险评估工具来评估潜在RSM。通过基于以下内容的评分系统评价参考工具中拟定的RSM。
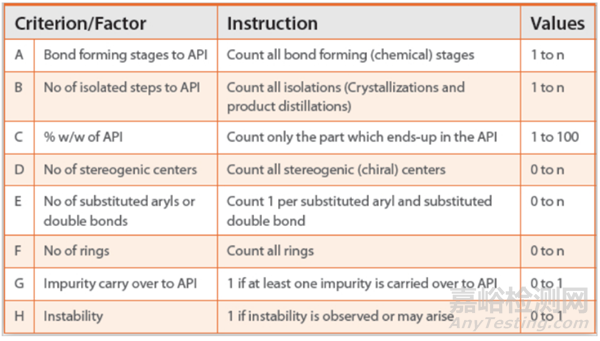
总体风险评分计算为4/A + 8/B + 0.6 C + D + E + F + G + H,评分等级分为<8、8-10和>10, 分别被视为低风险、中等风险和高风险。
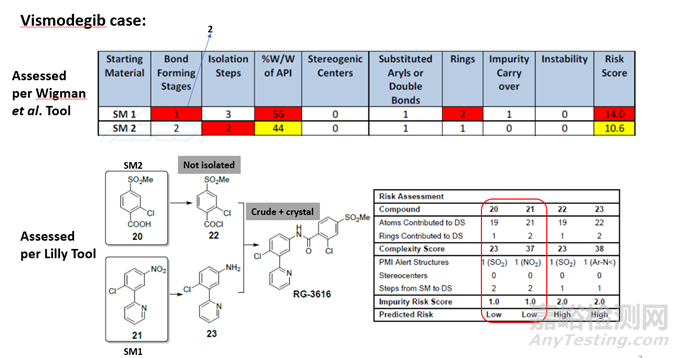
案例:—Vemurafenib
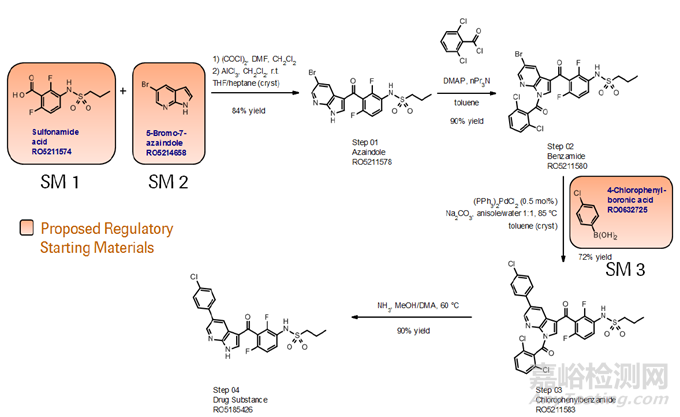
工具2(仅略作介绍,实际的可参考性较弱于工具1):
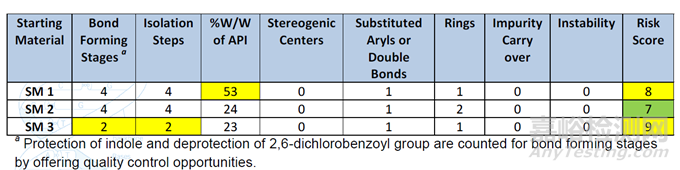
2019年,Eli Lilly发布了一种基于模型的工具,该工具源自偏最小二乘加判别的方法,该方法考虑了40个被认为可能导致 RSM 认定风险的不同分子和途径属性。该模型评价RSM风险主要基于RSM的复杂性和杂质风险评分两个方面:

评估工具的案例情况:
使用两种工具进行起始物料选择的风险,打分情况因各工具评估维度的不同而存在一些差异,整体的风险评估结论也会有所差异,最终论证各起始物料选择的充分性还需根据项目实际情况进行各评估维度的风险论述,说明相应的潜在风险点是否已合理控制且处于持续可控状态,对原料药的质量风险为低,进一步证实起始物料选择的合理性。
文章小结:
起始物料的选择及质量控制是原料药开发的重要组成部分,其定义和选择是CMC研究的一个重要部分,也是NDA注册审评中CDE、FDA和EMA等官方审评机构关注的一个永久性话题。近20多年来,在原料药注册技术文件要求中,这一话题一直广受关注。随着ICH Q11 指导原则的出台,ICH 各地区对起始物料选择的基本原则及质量控制要求已基本达成共识。
鉴于起始物料的重要性,各监管机构在原料药CMC的技术审评中均给予了高度关注。欧洲EDQM 发布的统计信息显示,CEP 证书新申请首轮审评发现的十大缺陷中,起始物料的选择问题位列第2 位,而位列第1 位的缺陷也涉及起始物料的杂质问题。
对于起始物料选择的合理性问题,本文提供了两种风险评估工具供参考,论述的重点在于按照ICH指导原则中对起始物料的相关考量要求。在美国FDA 仿制药(ANDA) 审评中,确定起始物料也被视为一个棘手的问题;对于新药申请(NDA),FDA 则与申请人提前沟通,双方通常会在Ⅱ期临床末的会议(IND End-of-Phase 2 meeting) 或者新药申请提交之前的会议( pre-NDA meeting) 上对起始物料的相关问题达成共识,申请人会提前与CDE进行沟通,会在Ⅱ期临床末的会议(IND End-of-Phase 2 meeting)中进行进一步的沟通,最终会在新药申请提交之前的会议( pre-NDA meeting) 上对起始物料的问题达成共识,同时针对官方在NDA审评阶段要求起始物料前延的潜在风险做好预案策略,降低因起始物料选择不合适、前延起始物料的发补项而影响注册审评的进度,最终影响新药上市获批的里程碑节点。
基于以上讨论章节中对起始物料的法规层面基本考量、质量控制的基本要求以及选择依据的主要论述点,在申报资料中,建议在3.2.S.2.3物料控制的起始物料章节中纳入以下几部分内容,1)起始物料生产商的名称和地址,并提供包括杂质谱在内的完整的质量标准;2)起始物料的生产信息,包括涵盖足够多合成步骤的工艺流程图,明确工艺中使用的溶剂、试剂和催化剂;3)各起始物料的质量标准、分析方法和检验报告,质量标准中除鉴别、含量等项目外,应特别关注对有关物质的质量控制;4)不同来源或采用不同工艺生产的起始物料可能有不同的杂质谱,如起始物料有多个来源或多种生产工艺/合成路线等,应分别提供相关的信息,并基于研究数据分析起始物料来源、工艺的不同对原料药质量的影响;5)原料药生产厂如需要对起始物料进行精制,精制工艺应包含在原料药的生产工艺描述中,并提供起始物料精制前后的质量标准。
CDE技术审评常见案例分享(起始物料相关问题):
常见问题1:请参照ICH M7、S9 等指导原则,基于本品的受试人群,结合起始物料以及本品制备工艺,酌情考虑开展遗传毒性警示结构杂质的研究,按照相关技术要求进行临床样品的控制。
常见问题2:现行起始原料杂质控制较为宽泛,临床试验样品采用的原料药的起始原料杂质水平“不得高于”毒理批次原料药的起始原料杂质水平。
常见问题3:请伴随临床研究进展及工艺研究的深入,参照ICH Q11 等技术要求合理指定本品起始原料(起始物料XXX和XXX结构相对较为复杂,建议前延),加强本品制备过程中主要杂质来源、转化、清除研究以及控制,关注起始原料和中间体有关物质方法对潜在杂质的分离检测能力,继续累积杂质检测数据,在此基础上制定合理的起始原料质量标准。

来源:注册圈


