您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-07-30 08:56
随着人民生活水平的不断提高,运动形式的不断丰富,全民健身运动的兴起,不可避免地引发运动损伤增加,运动医学领域也随之越来越受重视。运动医学类植入医疗器械包括由于运动损伤导致的韧带、关节囊、肌腱等软组织损伤治疗所用骨科植入物。目前,运动医学产品主要包括关节镜系统(包括主镜系统和动力刨削系统等)、重建系统(包括界面螺钉、带袢钛板、人工韧带等)和修复类系统(包括半月板修复系统、:带线锚钉、软骨修复系统等)。中国运动医学市场虽然发展较晚,规模较小,但市场规模增速远高于其他骨科植入产品。2023年11月,第四批国家组织高值医用耗材集采首次纳入运动医学类耗材产品,这使得运动医学产品受到了行业的关注,而其中可吸收运动医学产品也被进一步关注。
可吸收材料制成的运动医学产品[1]具有很多优点如无需二次手术取出,能够最大限度减少对影像学图像的干扰,随着降解过程逐渐转移载荷,从而减少应力屏蔽等;可以通过调整分子结构、分子量、结晶度和共聚物比例来设计最佳降解速率,从而匹配骨修复过程速率等优点;但这种材料也存在一些缺点,如机械强度较低,插入时有折断的风险,若材料不能完全吸收可能导致骨隧道变宽和组织连续性丧失等非预期生物反应目前,全球范围已批准了多种可吸收材料,如聚乙醇聚 乳 酸酸(polyglycolic acid,PGA)(polylactic acid,PLA )聚左旋乳酸(polylactic-L-acid,PLLA)、聚乳酸-乙醇酸共聚物(poly-lactic-co-glycolic acid,PLGA)和聚对二氧环己酮等可吸收材料,或由上述可吸收材料与无机材料[包括磷酸三钙(Calcium PhosphateTribasic,TCP)、羟基磷灰石(hydroxyapatiteHA)(无水)硫酸钙]复合制成的可吸收材料。
1、可吸收运动医学类医疗器械研究和应用进展
1.1可吸收界面螺钉
可吸收界面螺钉产品一般适用于软组织的移植固定境内外批准的适用范围基本一致。中国境内已上市的可吸收界面螺钉的适用范围一般描述为适用于手术中软组织移植物的固定和保持,适用部位可包括膝、肩、肘、踝、足、掌和腕部,具体适应证包括膝关节交叉韧带重建(包括前十字韧带、后十字韧带)等。FDA已上市的同类产品适用范围一般描述为适用于手术中将软组织附着于骨上,适用部位可包括膝、肩、肘部,具体适应证包括肩部的近端肱二头肌肌腱固定术、肩锁修复术,肘部的远端肱二头肌肌腱固定术尺侧副韧带修复、膝关节的内侧和外侧副韧带修复内侧髌股韧带重建(髌骨固定)、交叉韧带重建(包括前十字韧带、后十字韧带)等。
大量临床文献研究表明了该产品的有效性,即产品在正常使用条件下,能够实现预期用途,具备良好的固定性能,可达到预期性能。但可吸收界面螺钉也发生一些不良事件[2],主要包括:异物反应、骨整合不良(愈合不良)、"骨溶解、隧道变宽、局部积液引起的肿胀和疼痛、结膜炎、植入物断裂等。
1.2 可吸收带线锚钉
可吸收带线锚定一般适用于手术中肌腱、韧带等软组织与骨的连接固定。境内已上市的可吸收带线锚钉一般适用范围为手术中肌腱、韧带等软组织与骨的连接固定。FDA已上市的适用范围一般表述为适用于将缝合线(软组织)固定在肩、足/踝、髋、膝、手/腕肘等关节和骨盆、头骨的骨骼上。
临床文献研究表明了带线锚钉的有效性[3-5],其不良事件主要包括:固定失效(如肩袖再撕裂、再脱位、内固定松动)器械损坏、感染、过敏、疼痛等。
1.3软骨修复材料
软骨是一种致密的结缔组织,对于软骨需要修复的患者,目前采用的传统修复方法有微骨折手术、骨软骨移植术、骨膜移植术等,但自体移植来源有限,手术存在供源不足的问题,同时,同种异体移植也容易引发免疫排斥、传染病等其他问题[6]。是否可以开发合适的材料,通过一定的技术制备具有活性的组织工程支架以实现软骨组织的修复,有效解决上述问题直是研究的热点。常见的可吸收组织工程支架材料包括透明质酸、明胶、壳聚糖等。目前,我国用于软骨修复的可吸收组织工程支架刚刚实现产品转化,P上市产品较少。欧盟已批准多款相关产品上市,其材料主要多为透明质酸、水凝胶、天然无机碳酸钙等[7]。Bajuri等[8]通过一项对使用内踝截骨术和透明质酸支架移植联合治疗微骨折的患者的两年随访研成究表明,患者的疼痛缓解、日常生活活动、运动、活质量和精神状态都有显著改善。Glasbrenner等[9]对使用该产品的患者进行了最长108周的随访显示,使用该产品的治疗效果(包括疼痛、日常活动运动、娱乐及生活质量等评分)良好,且与微骨折术患者的疗效相当,发生的不良事件包括感染血肿、肿胀,经过干预处理后均恢复;未发生中度或重度过敏反应。Kolar等[10]开发了一种双相多孔可吸收组织再生支架,主要成分是相互连接的天然无机碳酸钙欧盟已批准其用于治疗关节软骨和/或骨软骨缺损。
1.4 其他可吸收运动医学产品
目前,半月板修复系统的固定棒主要为聚醚醚酮材料,FDA已批准的可吸收半月板修复系统产品材料主要为PLA、PLLA、PGA、PLGA等,适用于关节镜下固定位于半月板血管带区(红区和红-白区)的半月板撕裂。Petersen等[11]的一项对12项回顾性病例研究分析总结表明,在最长超过7年随访期的情况下可吸收半月板修复产品的临床效果良好,且不同手术术式对成功率的影响无统计学差异,但该研究表明儿童和青少年人群的失败率明显高于成人。MacLean等[12]研究显示,自2000年开始,随着运动医学治疗技术的发展,可吸收半月板修复产品临床效果良好,但术后固定棒断裂、修复失败、需要再次修复的比例较高,其效果取决于患者年龄、关节与前交叉韧带的稳定性。
目前,已有一种可再生的人工韧带获得了国家专利,其是一种具有组织重塑功能的可吸收韧带,经静电纺丝技术制成,具有良好的组织相容性和合适的机械强度,植入机体后,以纤维逐渐断裂的方式进行降解,在逐层降解的同时实现组织再生,诱导机体自身组织长入韧带,逐渐演变成自身韧带组织,实现腱骨融合,达到永久愈合[13-14]。
2、可吸收运动医学产品申报注册采用同品种比对路径的关键点
目前,对于已成熟材料(如聚乳酸类产品)可吸收运动医学产品(如可吸收界面螺钉、可吸收带线锚钉等)的申报注册,一般可以考虑采用同品种比对路径进行临床评价,对于申报产品与同品种产品的比对关键点及差异对产品安全有效性影响的分析,一般采用非临床证据(包括力学性能比对测试及动物实验数据)进行支持。
2.1 同品种比对关键点
2.1.1 同品种产品的选择
通常选择适用范围、适用部位、结构设计、材料尽可能相似的产品作为同品种产品,拟申报产品与同品种产品差异越大,论述等同性的难度越大。从基本原理、结构组成、生产工艺、制造材料、技术特征、生物学特性方面将申报产品与同品种产品进行详细对比,通常情况下,针对差异需进行进一步力学性能比对及动物实验比对[15]
2.1.2 适用范围的比对
运动医学产品可用于全身多个部位(如肩、肘、膝足/踝、手/腕、髋关节等)的多个适应证,每个适应证因软组织与骨的损伤、撕裂程度不同、术式不同,对应所需的产品不同,所选同品种产品应注意所应用的适用范围的一致性。提供植入前对骨的处理方法(如是自攻还是需要预钻孔,以及预钻孔的直径和深度等);描述所有与植入物联合使用的工具(如锚钉的插入器)。对于某些器械的设计,是否与缝线一起使用可由终端用户自行决定。如果申报产品不包含缝线,则应在注册资料和标签中详细说明建议使用的缝线尺寸(如线径)和类型(如可吸收缝线或不可吸收缝线)。
2.1.3 材料比对
对于聚乳酸类原材料对比项目可以参考相关标准进行,如YY/T0661-2017《外科植入物半结晶型聚丙交酯聚合物和共聚物树脂》[16]中的性能指标,上h对二者的外观、特性黏度、旋光度、水含量、锡含量、溶剂残留、单体残留、重金属残留等。
带有缝线的产品,应同时提供缝线所有材料(包括涂层和添加物)的材料成分、牌号。如果该缝线已获准上市,应提交其注册证编号。
2.1.4 结构设计比对
建议采用结构配合尺寸列表的方式表征申报产品与同品种产品结构设计的比对,标明关键尺寸,如长度内/外直径、缝线线径、缝线/锚钉连接机制,如果有多个组件(如骨锚钉的内组件和外套管),应提供如何组装这些组件的说明。
2.1.5力学性能比对
力学性能对比至少应考虑下面所列各类产品的主要力学性能项目(见表1)。
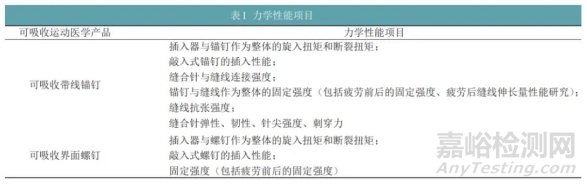
注册单元中存在多种结构设计,可论述相同适用范围(肩、膝、髋、肘肌腱韧带视作相同适用范围,足踝、手腕肌腱韧带、关节盂唇视作相同适用范围)不同结构设计对力学性能的影响,确定最差情况。针对不能被最差情况覆盖的型号,需单独选择最差规格与同品种产品进行比对为了确保螺钉在临床上可能遇到的任何骨质条件下均能安全植入,在力学测试过程中,模拟骨块的密度应与预期使用部位中骨质情况相对应,如在测试旋入扭矩及插入性能时,应选择较硬骨块进行测试,在进行固定性能测试时,应考虑模拟骨质最差(骨密度最小)情况。
2.1.6 缝线性能比对
缝线的性能一般包括但不限于YY0167-2020《非吸收性外科缝线》[17]所列的全部性能,如形式、结构、材料、类别、外观、线径、断裂强力、针线连接强力、褪色、长度、无菌、环氧乙烷残留量等。
2.2降解性能比对研究关键点
2.2.1体外降解
不同的可吸收材料降解性能不同,如PLLA是L型异构体形式的聚乳酸,其疏水性和对映体取向赋予了其高结晶度的特性,因此其降解时间较长;与PLA相比,PGA虽然结晶度高,但其缺乏甲基,故其降解相对较快。PLGA是PLLA和PGA的结合,具有可调节的降解性、亲水性。还可以通过对上述可吸收材料进行分子结构改性、表面改性、共聚改性等方式,获得符合预期降解速率、亲水性、热稳定性、生物相容性和可加工性的材料。为了减少酸性副产物的释放量、增强骨传导性能,将HA、B-TCP及其衍生物等,加入上述可吸收材料中,形成复合材料制成的可吸收运动医学产品。
很多因素可能会影响降解速率,包括表面积-体积比、关键设计特征的位置等,并且最差情况的组合或型号可能无法通过直觉获知(即也许并不是最小的型号规格)。应提供所选样品能够代表最差情况的合理依据。应选择最差情况的代表性样品进行测试。体外降解测试可参考YY/T0473-2004《外科植入物聚交酯共聚物和共混物体外降解试验》[18]等标准中规定的试验方法进行设计观察时间点的设定需考虑临床愈合时间。对产品降解性能的测试,至少达到预期愈合时间的两倍。研究产品在肌腱愈合期的力学性能变化情况,分别在软组织模型和骨-肌腱-骨模型下开展,比对申报产品和同品种产品轴向拔出力、固定强度等力学性能。表述整个测试过程中的材料降解情况(如质量损失、数均分子量或重均分子量变化),并绘制降解曲线,与同品种产品进錈鍘忻丕蹭藻浕励吩名比对。
2.2.2 体内降解
通过完全模拟临床使用的方式开展体内降解研究,可以同时直接评估产品对骨组织和软组织的影响,模拟临床真实使用部位对材料的反应情况,也可观察材料降解与骨长入的匹配情况。但植入样品在后期较难取出,且难以直接测试产品的力学性能在体内降解过程中的变化。可通过取出少量样品碎片、测试样品碎片的特性粘度,从而建立其体内和体外降解的关联性来评估产品在体内降解过程中的力学性能变化。也可通过分析产品的降解产物、降解速率,并与已上市的同类产品进行对比测试,完成产品降解对于软组织刺激的评估。
对于工艺成熟、质量可控的材料,也可考虑在动物实验中一并观察体内降解情况。
2.3 同品种比对差异部分研究及论证
2.3.1动物实验
针对可吸收类植入物一般需进行动物实验[19-20]并提供实验动物的选择依据,提供与拟申报产品预期用途相对应的解剖部位应用的动物模型的建立依据。
参考已上市可吸收界面螺钉和可吸收锚钉产品的动物实验研究,动物模型可选择羊或兔。
参考同类产品植入后周围组织达到稳定状态的时间以及通常使用动物模型进行植入试验的观察周期,观察指标可以考虑:①植入物尺寸变化;②骨长入体积变化;③植入物周围炎症反应情况;④肌腱韧带固定效果。观察方法主要有组织形态学观察、组织切片影像学等。
若申报的规格范围较广泛,可能会存在部分规格力学性能不能匹配所有适用范围中的部位,若出现该种情况,需在说明书中予以明确。
2.3.2论证差异不对安全有效性产生不利影响
申报产品与同品种产品可能存在部分差异,一般需结合上述试验结论来论述差异部分不影响其安全有效性。如申报产品与同品种产品结构尺寸存在差异性申请人可通过已上市同类产品论述结构设计的合理性,结合产品力学性能的比对、动物实验结果论述差异不对产品安全有效性产生不利影响。针对无法通过非临床数据来论证差异对安全有效性影响的情况,需要提交申报产品的临床试验数据作为支持。临床试验设计要结合产品的适用范围(适用部位)和降解周期进行设计,建议临床试验观察时间至少观察至降解稳态。
3、小结与展望
本文主要就部分可吸收运动医学产品进行概述,并结合部分成熟产品(如可吸收带线锚钉、可吸收界面螺钉)对产品上市前临床评价采用同品种比对临床评价路径的关键点提出了建议,明确了如何选择同品种产品,以及在如材料性能比对、力学性能比对,针对差异可以考虑进一步结合产品的降解性能、动物实验等比对测试结果进行论述,为行业提供上市前技术审评资料提供参考。
随着运动医学的逐步发展,患者对于生活品质预期的提升,可吸收材料的应用逐渐增多。对于不断开发出的新型可吸收材料,已有相当多的产品转化经验,如何在已有研究证据的基础上,通过精准的风险把控实现最少验证原则,稳妥而快速地验证最终临床效果,是未来临床评价的重点关注内容。
参考文献
[1] Ramos DM, Dhandapani R, Subramanian A, et al. Clinicalcomplications of biodegradable screws for ligamentinjuries[J].Mater Sci Eng C,2020,109: 110423.
[2]詹世平,阜金秋,王景昌,等.生物医用材料脂肪族聚酯的改性和应用研究[J].塑料科技,2020,48(4):116-124.
3]Cho CH, Bae KC, Kim DH. Biomaterials used for sutureanchors in orthopedic surgery[J]. Clin Orthop Surg, 202113(3):287.
4]Lee JH,Lee YB. Clinical and radiologic outcomes ofcombined use of biocomposite and PEEK suture anchorsduring arthroscopic rotator cuff repair:A prospectiveobservational study[J].jClin Med, 2020,9(8):2545.
5]袁心伟,张斌,胡豇,等.金属螺钉与可吸收螺钉修复下胫腓韧带复合体近期疗效比较[J].中国修复重建外科杂志,202236(8):989-994.
6]王莹莹,李花琼,赵子建,复合软骨修复材料支架的构建[J]温州医科大学学报,2019,49(8):581-588.
7]Rogers BA, Chahal J,Gross AE. Commercially availablebioengineered cartilage grafts[J]//Gahunia H,Gross APritzker K,et al. Articular Cartilage of the Knee. New YorkSpringer, 2020:427-443.
[8]Bajuri MY, Sabri S, Mazli N, et al. Osteochondral injury ofthe talus treated with cell-free hyaluronic acid-base0scaffold (Hyalofast®)-A reliable solution[y]. Cureus, 202113(9): e17928.
[9]Glasbrenner J,Petersen W, Raschke MJ, et al. Matrix-augmented bone marrow stimulation with a polyglycolicacid membrane with hyaluronan vs microfracture in locacartilage defects of the femoral condyles: A multicenterrandomized controlled trial[J]. Orthop J Sports Med,20208(5):2325967120922938.
[10] Kolar M, Drobniě M. Multilayered biomimetic scaffoldsfor cartilage repair of the talus. A systematic review of theliterature[J].Foot Ankle Surg,2023,29(1):2-8.
[11]Petersen W, Karpinski K,Bierke S, et al. A systematicreview about longterm results after meniscus repair[J]. ArchOrthop Traum Surg,2022,142(5):835-844
[12]MacLean lS,Miller MD. All-inside meniscal repair: Ahistorical view[J].Video JSports Med,2022,2(6):26350254221122614.
[13]Li Y, Chen C, Jiang J, et al. Bioactive film-guided soft-hard interface design technology for multi-tissue integrativeregeneration [J].Adv Sci,2022,9(15):2105945
[14]丁浩,阮水淼,王光达,等.人工韧带在膝关节韧带重建中的应用进展[J].临床医学进展,2022,12(8),7665-7673.
[15]国家药品监督管理局.医疗器械临床评价技术指导原则(2021年第73号通告)[EB/OL].(2021-09-28).https://www.cmde.org.cn//flfg/zdyz/fbg/fbgqt/20210929092409574.html.
[16]全国外科植入物和矫形器械标准化技术委员会.外科植入物 半结晶型聚丙交酯聚合物和共聚物树脂:YY/T0661-2017[S].北京:中国标准出版社,2017.
[17]全国外科器械标准化技术委员会.非吸收性外科缝线:YY0167-2020[S].北京:中国标准出版社,2020
[18]全国医疗器械生物学评价标准化技术委员会:外科植入物聚交酯共聚物和共混物体外降解试验:YYIT 0473-2004[S]北京:中国标准出版社,2004.
[19]国家药品监督管理局:医疗器械动物实验研究注册审查指导原则 第一部分:决策原则(2021年修订版)[EB/OL].(2021-09-18)[2023-08-28].https://www.nmpa.9ov.cn/directory/web/nmpa/xxgk/ggtg/ylqxggtg/ylqxqtggtg/20210927153130147.html
[20]国家药品监督管理局.医疗器械动物实验研究注册审查指导原则 第二部分:试验设计、实施质量保证[EB/OL].(2021-09-18)[2023-08-28].https://www.nmpa.9ov.cn/directory/web/nmpa/xxgk/ggtg/ylqxggtg/ylqxqtggtg/20210927153130147.html

来源:生物骨科材料与临床研究