您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-12-31 13:02
摘 要
药品注册核查是药品注册上市的主要环节之一,也是药品技术审评的重要支撑。本文通过对2023年批准上市的创新药药学研制和生产现场核查、药物临床试验现场核查情况进行综合收集和梳理,分析了新获批的创新药在药学研制和生产现场核查、药物临床试验现场核查存在的主要缺陷和一般缺陷,总结了创新药在药学研制和生产环节、药物临床试验期间存在的较为常见的不合规问题,为后续创新药物的研发和临床试验高质量开展提供参考和建议。
药品注册核查是为核实申报资料的真实性、一致性以及药品上市商业化生产条件对研制现场和生产现场开展的核查活动,是药品注册申请技术审评的重要支撑。2020年《药品注册管理办法》发布实施,正式确立了基于风险启动药品注册核查的制度模式,规定由药品审评中心(CDE)基于风险决定是否启动药品注册核查,由食品药品审核查验中心(CFDI)进行药品注册核查。2021年12月CDE发布的《药品注册核查检验启动工作程序(试行)》对启动药品注册核查的风险等级判定原则进行了规定,对高风险的药品注册申请应当启动注册核查。创新药由于创新程度高、工艺难度大、临床试验关键等原因,其品种因素一般会纳入高风险情形并启动注册核查。本文汇总收集了2023年国家药品监督管理局批准上市的40个创新药药品注册核查情况,对2023年批准上市的创新药物研制和生产现场核查报告、药物临床试验现场核查报告缺陷综合梳理分析,为后续创新药物的研制和生产、药物临床试验高质量开展提供参考和建议。
一、 2023年批准上市的创新药药品注册核查整体情况分析
据《2023年度药品审评报告》统计,2023年获批上市的创新药共计40个(以品种计,下同),其中15个品种纳入了加快上市审批程序,占比37.50%,通过早期介入、研审联动、加速审批等方式,加快具有临床价值的创新药上市速度,激发医药产业创新发展活力。
本文主要对除4个新型冠状病毒治疗药品外的其他36个创新药药品注册核查整体情况进行分析。从注册核查整体情况来看,36个品种均有开展注册核查。其中,涉及药学注册核查的品种31个(5个进口品种未在注册阶段开展药学注册核查),涉及药物临床试验现场核查的品种36个。核查结论均为通过。按照注册申请人地域分布分析,除5个进口品种外,其他31个创新药注册申请人所在省(市)分布广泛,覆盖12个省(市)。其中,江苏省8个,浙江省7个;北京市和上海市各3个;广东省和湖北省各2个;天津市、山东省、河北省、福建省、江西省、甘肃省各1个。属于长三角区域的达18个,占比50%,可见长三角目前依然是中国医药创新研发最活跃的区域。
二、 2023年批准上市的创新药药学注册现场核查情况分析
2023年批准上市创新药中31个品种开展了药学注册核查。在实际工作中,通常意义上将药学研制和生产现场核查统称为药学注册核查。一般情况下,在药学注册核查启动环节,研制和生产现场核查会整体评估并同步启动。研制现场核查的目的是确认药品开发阶段申报资料的真实性、一致性,生产现场核查的目的则是通过对药品商业化规模生产条件等进行核实与确认。
31个创新药品种药学注册现场核查涉及研制机构共计45家次,生产企业共计31家次;被核查单位的地域分布涵盖13个省、市、自治区。核查共计发现390项缺陷,研制现场共发现缺陷68项,占比17.43%;生产现场共发现缺陷322项,占比82.56%。
参考CFDI发布的《药品注册核查要点与判定原则(药学研制和生产现场)(试行)》及2010版《药品生产质量管理规范》,对研制现场及生产现场发现的问题进行归类统计,详细情况如下。
研制现场在申报资料真实性、数据可溯源等方面表现良好,发现的68项缺陷类型主要为质量管理方面的问题(39项,占比57.35%)和技术转移方面的问题(15项,占比22.06%),在稳定性研究(6项)、质量控制(3项)、处方和工艺(2项)、数据可靠性(2项)和对照品管理(1项)等方面均有少量分布。上述统计结果提示,在创新药物的研发过程中,质量管理仍是需要企业进行重点加强的方向,而研制机构与生产单位之间、企业不同部门之间的技术转移工作也需要着重改善。后续本文将重点对生产现场核查发现的问题进行统计分析。
生产现场发现主要缺陷共13项,占比3.29%,一般缺陷共309项,占比79.23%,未发现严重缺陷。从既往对仿制药的注册核查情况分析来看,创新药核查发现问题情况少于仿制药。13项主要缺陷和309项一般缺陷的类型分布见表1和表2。主要缺陷主要集中在确认与验证方面(5项,占比38.46%),此外,在文件管理、生产管理、质量控制与质量保证、无菌药品方面各发现2项主要缺陷。从缺陷的具体情形看,确认与验证不到位、生产过程中的污染和交叉污染、变更控制、无菌药品生产管理等方面的问题较为突出。
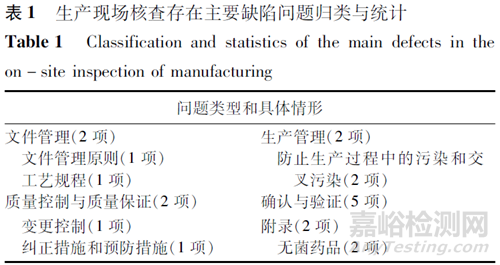

与主要缺陷分布相比,一般缺陷主要集中在质量控制与质量保证(72项,占比23.30%)和文件管理(71项,占比22.97%)两方面,确认与验证方面的问题共34项,占比仅为11.01%。对一般缺陷的具体情形进行分析可见,质量控制实验室管理方面的问题(44项,占比14.24%)和文件管理原则方面的问题(38项,占比12.30%)出现较为频繁。
总体而言,回顾31个创新药物的药学注册现场核查情况,均未发现严重缺陷,研制现场缺陷及生产现场发现的主要缺陷数量亦相对较少,与既往对仿制药进行药学注册核查发现问题的情况相比,创新药的研究质量表现明显更优,从药物研发的小试开发、放大、中试、试生产、工艺验证、稳定性考察直至完成商业规模生产的整个链条,都体现了我国制药企业已充分具备研究创新药的能力和水平。诚然,我国创新药物的研发能力与国际先进水平尚存在差距,但在审评审批制度改革持续推进的大背景下,该差距正在逐步缩小。
三、 2023年批准上市的创新药临床试验现场核查情况分析
2023年批准上市的创新药中36个品种开展了临床试验现场核查,被核查的临床试验项目共计38项。其中,Ⅲ期临床试验项目25项(占比65.79%),Ⅱ/Ⅲ期项目2项(占比5.26%),Ⅱ期项目5项(占比13.16%),Ⅰ/Ⅱ期项目3项(占比7.89%),Ⅰ期项目3项(占比7.89%),启动注册核查的临床试验项目一般为确证性的关键临床试验。接受现场核查的药物临床试验机构共计75家次,平均每个临床试验项目核查2家次临床试验机构,接受现场核查的生物样本分析检测单位和中心实验室共计9家次,被核查机构的地域分布涵盖19个省、市、自治区。
36个创新药品种临床试验现场注册核查共计发现446项问题(同一项试验的共性问题计为1项),发现重点关注问题22项(占比4.9%),规范性问题424项(占比95.07%),未发现严重缺陷。根据核查发现问题对问题的主要责任方进行初步归类,376项问题的责任方为研究者及临床试验机构(占比84.30%),43项问题的责任方为生物样本分析检测单位或中心实验室(占比9.64%),21项问题的责任方为申办者/合同研究组织/数据管理与统计分析单位(占比4.71%),4项问题的责任方为独立评估机构,此外有2项多责任方问题。
参考CFDI发布的《药品注册核查要点与判定原则(药物临床试验)(试行)》,对核查发现问题逐一进行归类统计,22项重点关注问题和424项规范性问题的类型分布见表3和表4。需审评重点关注问题主要集中在临床试验实施过程和临床试验数据采集与管理环节。从具体情形看,需审评重点关注问题通常是对试验数据质量和可靠性可能存在影响,或是对受试者安全和权益保护有着较大影响,例如纸质记录未能做到受控管理、死亡受试者仅有电话随访记录而无可靠死亡证明、中心实验室的检验方法未经充分方法学验证、研究者未按方案入组受试者等。与规范性问题相比,需审评重点关注问题中涉及数据管理与统计分析的比例更高,问题责任方也更加分散,研究者及临床试验机构问题占比(54.54%)相对总体比例更低,申办者/合同研究组织/数据管理与统计分析单位问题占比(22.72%)明显更高。


规范性问题主要集中在试验实施过程,最常见问题为不良事件(AE)漏记、AE与试验药物相关性判断不合理、病例报告表与源数据记录不一致、合并用药漏记、方案偏离或违背漏报、受试者入选/排除标准执行和证据留存不到位、源数据记录不够准确完整及时等。此外,记录不完整和不规范的问题在人员培训授权、伦理审查、试验用药品管理、生物样品管理与分析等多个方面都有着较高的发生率。
临床试验数据的真实、可靠、合规是药品审评审批的必要基础,也是开展技术审评的基本保证。有学者曾对我国与美欧日等发达地区的临床试验核查结果进行分析比较,从美国食品药品监督管理局对我国临床试验现场检查结果来看,2015年后我国实施的临床试验质量提升趋势明显,已能对标国际先进水平。2023年我国批准上市创新药的临床试验注册核查发现问题类型和严重程度,主要为规范性问题,需审评重点关注问题占比也较低,从侧面也反映了我国新药临床试验整体质量稳定向好。
药物临床试验从方案设计到组织实施再到最后的总结报告,是一项由多方共同参与协作的过程。从本文所分析核查情况看,任一参与方的质量管理意识和合规性不足均可能为试验带来质量风险。近年来我国临床试验数量大幅增加,行业的快速发展在促进创新研发的同时,也带来一些新形势和问题。例如,研究者、申办者及服务提供商的质量管理能力参差不齐,一些临床试验机构和研究者承接项目过多、履行临床研究责任的意识和能力有待加强,临床研究协调员与研究者职责边界混淆,申办者与临床试验项目研究机构之间(包括临床试验机构、中心实验室、生物样本分析检测机构、承担部分研究者职责的合同研究组织)存在利益关系等等。基于此,申办者应当增强质量管理意识,对参与方进行定期的质量管理培训和认证,建立更严格的审查和监督机制,确保各方履行职责,明确责任边界,加强申办者与研究机构之间的沟通,确保信息透明和合作顺畅。
四、 讨 论
随着药品审评审批制度改革的不断深化和持续推进,相当一部分生物医药企业迎来了收获期。通过对2023年批准上市的创新药药学、临床注册现场核查报告的分析来看,尽管其或多或少都存在一些研究缺陷,但药品研制的合规性、数据可靠性均不存在问题,我国创新药的研究质量整体趋势向好,为持续打造自我造血的源头创新提供了良好的药物研发生态。生物医药企业和药物研发创新各参与方应牢固树立质量意识和风险管理理念,严格遵守相关法律法规和技术指导原则的要求,履行好自身主体责任,管理好产品上市申请注册,做好积累沉淀。药品监管部门则需进一步发挥好政策的引导撬动作用,吸引和鼓励各方参与到药物研发生态共治中去,共同支撑以临床价值为导向的研发、以市场价值为导向的转化,促进创新药物加快研发上市,打造可待续发展及具备国际竞争力的医药创新研发生态。
行业新业态的出现对药物研发质量风险的影响值得关注。以临床试验研究为例,通过对药物研发生产主体的合规信息分析发现,部分参与临床试验的临床试验机构、生物样本分析检测机构、CRO公司等或临床试验项目研究机构之间存在利益冲突,如BE研究中临床试验机构与生物样本分析单位经常性地参与同一临床试验,CRO公司同时作为生物样本分析检测机构参与临床研究等,应当加强对可能影响临床试验数据质量和受试者安全权益等利益冲突情况的风险防范,有针对性地提高对可能存在利益冲突的临床试验的核查力度。与此同时,需对业界、临床试验机构持续加大药物临床试验质量管理规范教育、宣传和培训,推进行业自律,提升临床试验质量意识和合规意识。
持续巩固和优化基于风险启动及组织实施注册核查的模式,将“以风险为基础”的合规体系视为有效合规的基础标准。一方面,基于研发生产主体合规信息库系统整理研发生产主体的既往接受注册审查信息、监督检查情况、整改情况等总结风险要素,科学遴选和细化风险要素指标并赋予权重比例,建立综合各风险要素指标的数字化风险评估模型,加强核查启动的针对性。另一方面,建立基于风险的核查场点选择模型,明确现场核查中需重点关注的场点和研究内容。在开展常规资质合规性、流程规范性、数据完整性核查工作的同时,坚持积累和完善合规历史数据,不断总结核查发现问题态势,持续优化场点选择模型,以期提升现场核查的精准性、靶向性和科学性,实现核查资源的高效合理利用。

来源:CJCP临床药理学


