您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-01-07 18:47
近日FDA发布医用脉搏血氧仪指南草案“Pulse Oximeters for Medical Purposes: Non-Clinical and Clinical Performance Testing, Labeling, and Premarket Submission Recommendations”,这个草案定稿后将取代2013年发布的血氧指南“Pulse Oximeters - Premarket Notification Submissions [510(k)s]”。
本指南草案定稿后,旨在:
· 告知脉搏血氧仪是如何测试和评估的,以支持上市前提交。
· 确保设备标签,包括说明书,有助于促进脉搏血氧仪的安全和有效使用,并帮助人们了解使用它们的受益和风险。
· 促进脉搏血氧仪上市前提交的一致性,并促进对其进行有效审查。
FDA要求在指南草案发布后的60天内对其进行评论。FDA将审查和考虑所有意见,然后最终确定本指南。
此次血氧指南的更新的主要变化点包括以下四点:
1. 收集临床数据(例如,受控去饱和实验室研究,或在某些情况下,真实世界数据)以评估设备在不同皮肤色素沉着范围内的性能准确性;
2. 增加临床研究参与者的数量,新指南草案要求至少150名参与者;
3. 使用主观(Monk Skin Tone Scale)和客观(calculation of individual typology angle)方法对研究参与者的肤色进行更标准化的评估,并准确评估设备在各种皮肤色素沉着中的性能;以及
4. 如果在新的上市前提交中证明了设备性能的准确性,增加一则显著的标签声明,以帮助用户清楚地识别脉搏血氧仪已被证明在不同皮肤色素沉着人群中的性能相当。
在FDA新闻发布信息中更是指出,FDA可能要求已经获批的血氧仪符合目前草案指南中的性能标准,这些血氧仪的赞助商可以在满足了在不同肤色范围内新的性能要求之后递交更新后的标签,FDA会在30天内快速审查。
新的血氧指南草案适用范围
这则更新的血氧指南草案适用于某些医用脉搏血氧仪,主要用于医院或医生办公室。用于医疗目的的脉搏血氧仪通常用于监测(即,趋势分析或抽查)患者的氧饱和度水平,以帮助临床决策。
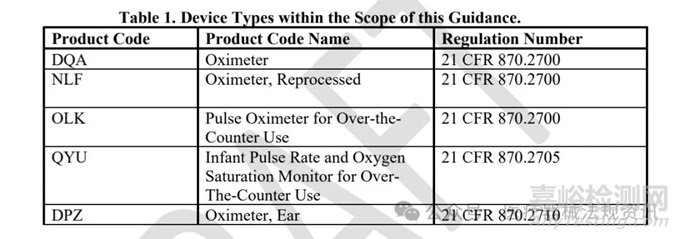
适用的血氧仪包括下图中的产品代码为DQA,NLF,OLK,QYU 和 DPZ的血氧仪。其中OLK和QYU均为OTC血氧仪。
本指南草案不适用于作为一般健康产品或运动/航空产品出售的脉搏血氧仪,这些产品在向公众提供之前未经管理局审查或评估。这类产品通常在商店或网上直接销售给消费者,并且通常用于估计氧饱和度,以达到一般健康的目的(即,鼓励一般的健康状态或健康的生活方式)。迄今为止,市面上的大量脉搏血氧仪或用于运动/航空的脉搏血氧仪被认为是普通健康产品,未经FDA评估,无法用于临床决策或确定是否寻求医疗干预。
新的血氧指南草案关于临床研究的主要变化
这则更新的血氧指南草案关于临床研究的主要变化点包括:
1. 受试者数量要求至少150名,包含不同肤色人种,且每个受试者至少20对血氧数据,总的血氧对数据要求至少3000对。
2. 对受试者招募的要求更严格,除了ISO 80601-2-61 标准中的入排标准,还额外要求通过MST和比色法对受试者进行额头色素沉着进行评估,并按MST水平进行分组。
3. 对总体受试者要求不同MST分组和不同血氧饱和度水平各三个范围各至少30%。
4. 对人口统计要求提供更多信息,需要包括以下:
• Age;
•Sex;
•BMI;
•Self/caregiver-reported ethnicity;
•Self/caregiver-reported race;
• Forehead MST and ITA values of each participant;
• ITA value at the emitter sensor site placement;
• Range of applicable dimension(s) of sensor site anatomy;
• Range of percent modulation in study participants when obtaining data pairs (SaO2, SpO2); and
• Percent of each MST group that tolerated full desaturation (down to SaO2 of 70%).

来源:医疗器械法规资讯


