您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-01-13 08:33
关节内给药(Intra-articular, IA)可以直接靶向关节,用于治疗多种关节病(如骨关节炎、物理创伤、类风湿性关节炎、痛风性关节炎或假性痛风)。IA给药能最大限度的提高疗效并减少毒性。当然,这种给药方式也有缺点,需要由一位经验丰富、技术熟练的人给药,不仅可以避免医源性损伤、出血或感染,还可以将目标剂量药物准确递送到正确的位置。
解剖特点
不同动物种属的关节解剖特征与人体是非常相似的。膝关节是人体最大的滑膜关节,临床上最为多见,也相对容易操作,是本文讨论的重点。当然,理论上所有关节都是可以注射的。膝关节空间比较大,注射后的药物可以充分分布。滑膜表面和隐窝向上延伸至股骨两侧,向下延伸至胫骨两侧。在关节的十字韧带连接处经常有一些区域(含微腔和不平整结构),类似囊样凹槽,会积聚滑液和注射物,并在股骨-胫骨和股骨-髌关节空间内自由流动。在正常动物中,滑液会薄薄地覆盖各个表面,但不会填充整个关节空间。当出现关节炎时,滑液体积增加,可以填充大部分空间,通常会肿胀。
已有多种方法用于评估软骨和滑膜表面积,如下表所示。
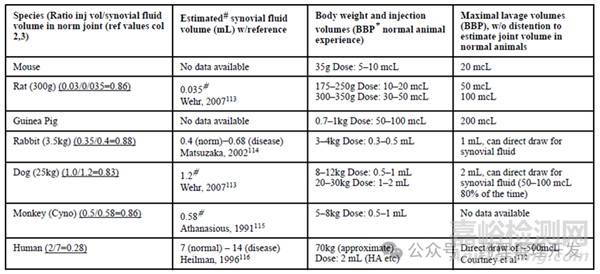
毒理试验种属选择
首先在毒理试验之前,通常会开展关节内给药的药效学研究。除了镇痛适应症以外,大部分关节用药药物的有效性终点会涉及组织病理学检查。通过药效学动物模型,可以为毒理试验种属选择提供很多信息。比如骨关节炎模型主要分为两种,一种是手术造模,如半月板损伤模型(meniscal destabilization, DMM)、前交叉韧带横断模型(nterior cruciate ligament transection, ACLT)、内侧半月板撕裂模型。另外一种是化学试剂造模,如单碘乙酸盐造模、单钠尿酸盐晶体造模等。这些模型在小鼠中应用很广泛,也很常见。虽然给药会有些挑战,但也是可以实现关节内给药。其实将小鼠作为药效学和毒理研究种属的主要挑战还有几点,一是小鼠有自发的内侧软骨退化情况,且随着年龄增长,还会加剧。二是小鼠关节内注射有引起交叉韧带损伤的趋势,有点类似ACLT。另外,小鼠的关节内注射剂量要控制,避免引起关节肿胀。最后,在小鼠中监测关节肿胀和疼痛比大动物种属更具挑战。
大鼠也是骨关节炎模型的常用种属。小鼠中的模型几乎在大鼠中均能实现。而且大鼠没有小鼠的年龄相关的内侧软骨退化问题。选择大鼠的一个挑战的是,大鼠有比较高的软骨囊肿情况,尤其在关节外侧。不过,这一自发性变化比较容易鉴别,所以影响有限。而且,大鼠经关节内给药后的临床毒性评估,如膝盖肿胀、步态异常等,也很容易实现。
与大鼠和小鼠类似,豚鼠也可以通过很多手术、化学试剂制备关节疾病模型。不过,豚鼠存在的问题是该种属从3个月开始出现自发性的膝盖骨关节炎,并在12-18个月进展到严重的程度。这种情况的存在,可能会使关节内给药毒性结果的评估复杂化。
兔关节内空间大,没有自发软骨退化问题,也是个理想的动物种属。唯一有些挑战的是兔久坐和比较特别的步态(跳跃),可能对疼痛和肿胀的检测带来一些困难。相比之下,比格犬更为理想,关节空间大,没有自发软骨退化,毒理终点如肿胀和步态也很方便评估。当然,猴也是常用非啮齿类种属。不过,猴存在软骨囊肿和自发胫骨内侧软骨退化问题。
总体来看,大鼠和犬是比较理想的关节内给药种属,容易操作,关节内给药体积能满足常规要求,几乎没有自发软骨退化出现,不会使毒理学结果的解释复杂化,而且这两个种属的毒理终点评估如肿胀、步态异常,也很容易实现。不过,这只是从膝关节解剖和病理生理学特点进行的考量。常规相关种属确定路径,如生物药与不同种属的靶点结合和活性等也需要评估。不过,如果在该种属中已经能做出药效,说明具备体内活性,自然也应该是相关动物种属。
关节内药物递送
关节内给药属于非常规给药方式,动物需要麻醉,以避免动物意外活动造成损伤。给药用的针头规格应尽可能小,尽可能短,避免对关节造成创伤。给药体积应根据动物关节大小进行调整(见前文表格),避免出现体积过大,关节过度扩张,引发炎症或刺激,而且还可能会导致药物清除加快。还要注意不要将针插入关节后部太远,这可能会碰到膝盖后部的腘动脉并导致出血。
关节内给药的毒理终点评估
应在给药后24h内观察关节肿胀情况,并根据严重程度适当延长观察周期。大鼠可以用卡尺直接测量膝关节肿胀程度。犬则可以借助绳索绕膝关节一周,然后测量绳索长度变化。如果确实观察到肿胀,拟进一步考察疼痛程度,可以通过测力板考察站立疼痛,通过步态分析考察移动疼痛。
与其他药物类似,组织病理学检查也是关节内给药药物毒理学评价的核心指标。尤其是对一些不可逆变化的指标考察,比如胶原基质损失和软骨细胞的死亡。软骨细胞死亡的原因通常有两种,一种是药物的直接毒性,一种是中性粒细胞引起的炎症导致的。一旦发现软骨细胞死亡,是需要明确原因的。因为,如果是炎症原因所致,可以通过改变溶媒或者调整操作改善。如果是药物直接毒性,那就没有办法了。除了不可逆变化,有些毒性发现是可逆性的。即使关节内注射生理盐水,也会出现诸如轻微的急性滑膜炎和软骨的蛋白聚糖损失。不过,这些毒性在注射一段时间后,可以完全恢复。还有些长时间释放药物(比如一些缓释和控释制剂)的颗粒物通常会滞留在滑膜中,引起一些慢性炎症,当这些物质被巨噬细胞处理/清除后,炎症会消退。
关节内给药毒理研究的其他常规考量
除了前文提及的给药体积问题,还需要注意给药间隔,即频率问题。很多关节内给药制剂粘度比较高(如透明质酸),需要给关节留出足够时间清除这些物质。高粘性物质聚积会引起严重的关节炎和软骨细胞死亡/关节内基质破坏。如果在下次注射前,这些物质已被充分清除,可以减少这类问题的出现。不同产品在关节内滞留时间不等,从数分钟到几个月的情况都有,需要根据实际检测情况确定。
动物年龄也很关键。具有闭合关节/骨骺生长板的成熟动物,与不成熟动物相比,软骨对一些损伤的反应是不同的。大鼠约11周,犬约7个月,达到与成年人一样的成熟程度。
建议始终使用冠状面组织切片(而不是矢状面)进行组织病理学评估。因为动物膝盖两侧的承重是有差异的,会影响病变的发展,一些自发变化往往发生在其中一侧。冠状面切片可以准确识别关节的内侧和外侧区域,以便对诱发和自发损伤进行详细评估。例如,关节内侧的更多承重可能会导致与弥漫性炎症变化相关的更大面积软骨细胞死亡(内侧),而且承重差异通常会导致优先承重侧的软骨下骨增加。另外,毒理研究设计应具有足够的持续时间,以确定软骨细胞死亡是单次或多次给药导致的。关节病理切片染色方面,甲苯胺蓝等阳离子染料染色比标准的苏木精和伊红(H&E)染色更有用。阳离子染料与软骨基质中带负电荷的蛋白多糖结合,从而更有助于识别蛋白多糖减少的区域。有助于病理学家识别早期软骨细胞死亡的区域,因为当软骨细胞死亡时,蛋白多糖会随着时间的推移而丢失(起初是轻微的,然后是永久的、严重的)。使用甲苯胺蓝染色可以很容易地观察到炎性细胞浸润、滑膜纤维化、软骨下骨吸收和绝大多数其他对关节病理评估很重要的变化。
最后,再强调一下关节内不可逆变化如软骨细胞死亡考察的重要性。关节内给药需要找到出现这一变化的安全边界,或者是找到治疗窗口。如果可以,能收集到滑膜液药物浓度最好。如果不行,可以通过固定给药体积,增加给药浓度,探索这一边界。如果药物溶解度有限,不能实现浓度在一定范围的变化,也可以考虑固定浓度,增加给药体积,但体积一定要在前文表格中限定的合理范围之内。也可以结合动物药效研究数据,确定药物的安全窗口。

来源:药理毒理开发


