您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-03-03 08:26
ICH S7A于2001年发布,其中提到将呼吸系统研究作为安全药理研究的关键组合之一。这一思路被工业界延用至今,算算已有20多年。呼吸系统安全药理研究成了新药非临床研究的强制性要求。然而,回顾性分析发现,作为三大组合之一的心血管安全药理临床前研究具备不错的临床转化效果,中枢神经系统和呼吸系统的非临床/临床结果间的可转化性,甚少有研究披露。当然,部分原因可能是临床前设置的呼吸系统安全药理研究终点如呼吸速率、潮气量等,早期临床阶段并未采集。
基于此,由Novartis、Eli Lilly、Ability、Pfizer、Abbvie、Roche、Amgen等组成的工业界安全药理小组对459个不同分子的呼吸系统安全药理临床前/临床研究数据进行了总结和分析。其中,小分子384个(84%),大分子75个(16%)。临床前呼吸系统数据主要提取自单独的呼吸系统研究(395,86%),或伴随单次/重复给药毒理研究(64,14%)。暴露量数据则来自伴随开展的PK研究,或其它可参考的试验,比如重复给药毒理研究Day1 TK数据。临床数据则来自FIH单次/多次剂量爬升试验。
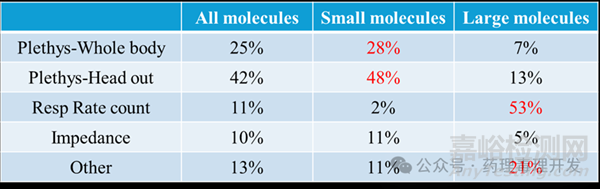
459个分子中,大部分呼吸系统安全药理数据采集自头部外置体积描计器(42%),全身次之(25%)。如果将大分子和小分子分别单独统计,数据收集技术还是有些区别的,小分子以头部外置装置为主,大分子则以呼吸速率计数居多。可能与小分子和大分子呼吸系统安全药理研究常用种属不同有一定关系。
459个分子中,以口服给药为主(73%),静脉次之(16%)。非临床研究种属方面,大鼠使用最多(66%),猴(19%)和犬次之。
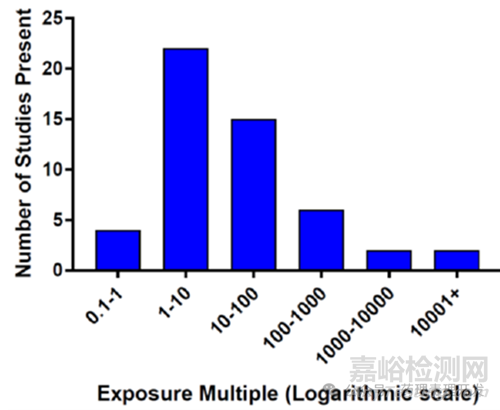
459个分子中,309个推进到FIH临床阶段。66个分子出现临床呼吸相关的AE。比较有意思的是,仅12个分子同时发现供试品相关的临床前呼吸参数改变,大部分分子并未观察到临床前和临床呼吸系统相关毒性的一致性结果。那么为什么54个(82%)分子临床前和临床研究结果不一致呢?是不是因为临床前暴露量过低所致呢。其实不是,绝大多数分子临床前动物体内的暴露量是临床的1倍以上。
基于以上数据,研究团队认为临床前呼吸系统安全药理学评价对于临床呼吸系统相关不良反应的预测价值非常有限。既然如此,单独开展动物呼吸系统安全药理的意义还有多大,可不可以在其它毒理试验中伴随考察,比如嵌入重复给药毒理试验中,又如在心血管安全药理试验中同时收集呼吸系统数据。关于嵌入毒理试验,其实ICH S9、ICH S6是明确允许的,只不过这俩指南适用于抗肿瘤药物和生物制品。有鉴于此,是否可以考虑扩大这一思路的应用范围,比如非肿瘤适应症、非生物制品。
最后,不知道大家是否想到一个问题,这12个分子既然在临床前观察到呼吸系统安全药理学结果的异常,为什么还是进了临床阶段呢?答案很简单,大部分企业并未将呼吸系统毒性作为候选分子禁止进入临床的标准。而且,监管机构也没有明确规定禁止这类产品进入临床。更多还是用于临床风险提示。但从现有数据看,动物呼吸系统安全药理学数据的临床转化性和预测性的价值过于偏低。甚至有团队(Valentin and Leishman,2023)认为呼吸系统安全药理研究不应作为“core”assay之一,即不作为核心组合试验,而是将其重新归类为补充的安全药理学试验。

来源:药理毒理开发


