您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-03-03 08:33
2025年2月21日,FDA批准了CtexliTM(chenodiol)用于治疗成人脑腱黄瘤病(Cerebrotendinous Xanthomatosis,CTX)。在此之前FDA同时授予其优先审评、快速通道和孤儿药资格认定。CtexliTM是全球首个获得FDA批准用于治疗CTX的药物。
1、CTX发病机理
脑腱黄瘤病是一种罕见的遗传性胆汁酸合成障碍疾病,由CYP27A1基因突变引起,导致一种参与人体胆固醇转化为胆去氧胆酸的线粒体酶(甾醇27-羟化酶)缺乏,为常染色体阴性遗传性代谢疾病。由于肝脏胆汁酸生成减少,CTX患者无法正常分解胆固醇,导致异常的代谢产物,如胆固醇和胆烷醇在神经细胞和细胞膜中沉积,累及大脑、肝脏、皮肤、肌腱、脊髓、晶状体等。

CTX的病理生理学示意图[1]
2、流行病学
发病率和患病率
全球范围内CTX的发病率估计在1/36042到1/468624之间;在美国,CTX的患病率估计为每10万人中3到5例。目前已报告的全球病例数约仅为425例,而实际患病人数可能远高于此,CTX的临床表现多样且复杂,包括慢性腹泻、白内障、腱黄色瘤、神经功能障碍等,症状的起始和严重程度差异较大,导致该病常被误诊或漏诊,提示该病可能被严重低估。
临床表现
CTX的症状通常从儿童期开始展现,如慢性腹泻、新生儿黄疸等,随后可能出现白内障(青少年期)、腱黄色瘤(青年期)和神经功能障碍(成年期)。由于症状多样且缺乏特异性,CTX的平均确诊年龄为35.5岁,导致许多患者在疾病晚期才被诊断,错过了预防不可逆神经损伤的时机。
3、CtexliTM(chenodiol)
基本信息
Chenodiol主要成分为胆去氧胆酸(chenodeoxycholic acid,CDCA),是一种内源性初级胆汁酸。CtexliTM通过补充体内缺乏的胆去氧胆酸,恢复胆汁酸的正常代谢,减少异常代谢产物的积累。同时,补充的胆去氧胆酸水平的增加可以激活法尼酯X受体(FXR),进而下调胆固醇7α-羟化酶(CYP7A1)的表达。CtexliTM针对脑腱黄瘤病曾在2017年04月10日获得EMA批准,商品名是Chenodeoxycholic acid leadiant (previously chenodeoxycholic acid sigma-tau)®,为规格是250 mg的硬胶囊剂型。本次获批剂型为250mg的口服片剂。
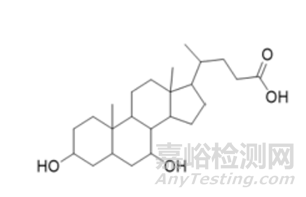
3α,7α-二羟基-5-β-胆烷-24-酸,分子式为C₂₄H₄₀O₄,分子量为392.58 g/mol
临床结果
CtexliTM本次获批基于一项随机、双盲、安慰剂对照、2周期、2治疗交叉试验(NCT04270682)的临床试验数据。共纳入14名患者,其中13名患者被随机分配并按照交叉撤药设计接受250 mg或安慰剂,持续4周,共两个双盲治疗期。研究还包括在2个双盲撤药期之间进行的8周导入期和8周开放标签期。在13名随机分配的患者中,62%为男性,39%为女性。基线中位年龄为42岁(16-55岁),中位确诊年龄为35岁(15-55岁)。长达24周的试验表明,与安慰剂组相比,CtexliTM(250 mg×3/day)治疗可显著降低CTX患者血浆胆烷醇和尿液23S-戊醇水平。
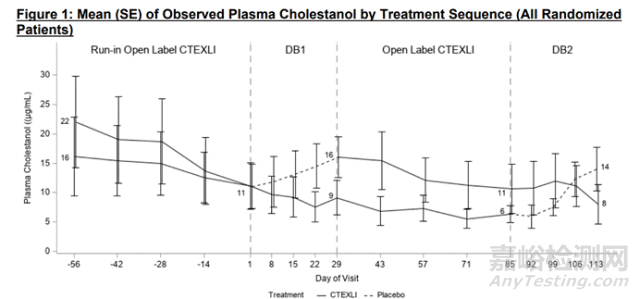
随机分配的患者按治疗顺序观察到的血浆胆固醇醇的平均值图片
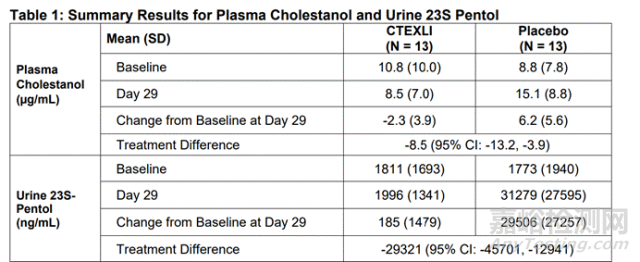
血浆胆固醇醇和尿液23S-戊醇的总结结果
安全性
NCT04270682试验评估产品的不良反应发生率。其中发生率≥14%的最常见不良反应为腹泻(36%)、头痛(21%)和腹痛(14%)、便秘(14%)、高血压(14%)、肌无力(14%)和上呼吸道感染(14%)。1例接受CTEXLITM治疗的患者(7%)出现ALT水平升高超过正常上限3倍,导致治疗中断。
4、竞品格局
目前全球针对CTX适应症的上市产品仅CtexliTM一款。此外,由Vivet Therapeutics研发的一种腺相关病毒载体基因疗法VTX-806,VTX-806通过AAV载体将功能性CYP27A1基因递送至肝脏,恢复正常的胆汁酸合成。目前正在临床前研究阶段,接受AAV8-EAAT-CYP27A1基因疗法的CTX小鼠,其肝脏重量相对于体重的比例显著下降,接近野生型小鼠的水平,体现出剂量依赖的肝肿大逆转能力[5]。该疗法已于2024年9月获得EMA授予的孤儿药资格。
VTX-806基因疗法逆转CTX小鼠的肝肿大[5]
总结:
孤儿药研发在政策支持、技术创新和市场需求的推动下,正迎来快速发展。未来,精准医疗和基因疗法的进步将进一步提高孤儿药的研发效率。然而,如何平衡经济激励与患者可及性,确保孤儿药的可持续发展,仍是行业面临的重要挑战。CTX作为一种进展性多系统疾病,对患者影响显著,此前一直缺乏获批的治疗方法。今天CtexliTM批准为CTX患者提供了一种安全且有效的治疗选择。
资料引自:
1、Nobrega PR, Bernardes AM, Ribeiro RM, et al. Cerebrotendinous xanthomatosis: a practice review of pathophysiology, diagnosis, and treatment. Front Neurol. (2022) 13:1049850. doi: 10.3389/fneur.2022.1049850.
2、LING C X, GAO S Z, LI R D, et al. Cerebrotendinous xanthomatosis presenting with schizophrenia-like disorder: A case report[J]. World J Psychiatry, 2023, 13(11): 967-972. DOI: 10.5498/wjp.v13.i11.967.
3、Chenodiol药物说明书
4、Clinical trials.com
5、Lumbreras, S., Ricobaraza, et al. . Gene supplementation of CYP27A1 in the liver restores bile acid metabolism in a mouse model of cerebrotendinous xanthomatosis. Molecular Therapy: Methods & Clinical Development (2021), 22, 210-221.

来源:药事纵横


