您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2017-12-04 09:38
医疗器械,就是指直接或者间接用于人体的仪器、设备、器具、体外诊断试剂及校准物、材料以及其他类似或者相关的物品,包括所需要的计算机软件。市面上小到创可贴、医用棉签和温度计,大到核磁共振、呼吸功能监护仪,都统称为医疗器械。作为与人类的疾病治疗和健康防护息息相关的医疗设备,对其进行正规严格的分级分类是十分必要的。
新版《医疗器械分类目录》
近年来,我国医疗器械产业快速发展,目前全国约有7.7万余个有效医疗器械注册证和3.7万余个医疗器械备案凭证。随着新技术、新产品的不断涌现,现有医疗器械分类体系已无法完全适应医疗器械行业发展和监管工作需要,我国2002年发布实施的《医疗器械分类目录》的不足日益凸显。
2017年8月31日,国家食品药品监督管理总局(CFDA)发布了新版《医疗器械分类目录》,该分类政策将于2018年8月1日起正式施行。新《分类目录》原来的43个子目录精简为22个。具体如下:

旧版《医疗器械分类目录》:

新增人工智能辅助诊断相关分类
虽然新版目录在结构上有所精简,但在内容上却更加细化,由原来的15页增加到150余页,并对两千余项产品的预期用途和产品属性进行了精炼的描述;产品名称举例的数量也增加了6倍,达到6609个,其中医用成像类器械所占比重明显增加。以下是新版目录中成像类器械的官方分类及举例:
|
管理类别 |
编码代号 |
分类名称 |
品名举例 |
|
Ⅲ类 |
6828医用磁共振设备 |
医用磁共 振成像设备(MRI) |
永磁型磁共振成像系统、常导型磁共振成像系统、超导型磁共振成像系统 |
|
6830医用 X射线设备 |
X射线治疗设备 |
X射线深部治疗机、X射线浅部治疗机 X射线接触治疗机 |
|
|
X射线诊断设备 及高压发生装置 |
200mA以上X射线诊断设备 |
||
|
X射线手术影像设备 |
介入治疗X射线机 |
||
|
X射线计算机断层 摄影设备(CT) |
X射线头部CT机、全身CT机、 螺旋CT机、螺旋扇扫CT机 |
||
|
Ⅱ类 |
6830医 用X射线设备 |
X射线诊断设备 及高压发生装置 |
200mA以下(含200mA)X射线诊断设备 |
|
6831医用X射线 附属设备及部件 |
医用X线影像系统 及成像器件 |
医用X射线电视系统、数字减影系统、 X射线影像增强系统、激光相机、 X射线像增强器、医用透视荧光屏、 医用间接摄影荧光屏 |
|
|
X射线透视、 摄影附加装置 |
高压注射器、防散射滤线栅、 荧光摄影装置、胸片摄影装置 |
其中尤为引人注意的是其新增了与人工智能辅助诊断相对应的类别,在目录中具体体现在对医学影像与病理图像的分析与处理:
|
管理 类别 |
编码代号 |
分类名称 |
品名举例 |
|
Ⅲ类 |
6870软件 |
诊断图象 处理软件 |
数字影像接收系统、X射线影像处理系统、X射线计算机断层摄影设备成像用软件、血管内超声成像系统(IVUS)、核医学成像、医用磁共振成像系统 |
|
Ⅱ类 |
6821医用电子仪器设备 |
光谱诊断设备 |
医用红外热象仪、红外线乳腺诊断仪 |
|
6870软件 |
诊断图象 处理软件 |
CR/DR 、病理图像分析系统、显微分析系统、 红外热象处理、数字化超声工作站、 超声三维成像系统、舌象仪 |
|
|
诊断数据 处理软件 |
24小时全信息动态心电分析系统、24小时全信息动态脑电记录分析系统 、脉象仪、脑电(肌电)诊断分析系统 、睡眠监护系统 、血流变数据处理软件、 激光(血液分析仪、激光全息检测仪)数据分析软件 |
||
|
影象档案传输、 处理系统软件 |
PACS 、远程诊断 |
||
|
Ⅰ类 |
6831医用 X射线附属 设备及部件 |
医用X线胶片 处理装置 |
X射线胶片自动冲洗机、胶片影像处理系统 暗室灯、 X射线胶片观察装置、医用X光胶片 |
随着医疗信息化的快速发展,越来越多的企业开始投身于医疗大数据行业,智能化医疗产品开始日益受到重视。对于新版的《医疗器械分类目录》,有专家总结说,新版目录更便于及时修正,细化与更新,而这“更新”的部分就主要在于人工智能辅助诊断方面的软件及设备的日新月异,层出不穷,对医疗的干预也逐渐增加。在机器学习与深度学习越来越风靡的高科技行业中,利用人工智能进行影像三维分割、病理图像分析处理、个性化精准医疗等方面的工作来辅助医生进行诊断与治疗方案拟定已经日渐普及。
加速CFDA申报至关重要
有发展,就有限制发展。AI辅助医疗对医生的诊断有一定的导向作用,自然而然要承担一定程度的风险,随着智能产品的介入增多,其所承担的安全责任也就越大,法律法规的管控也随之愈加严格。若想盈利,就要与医院进行合作,要实现合法收费获利,通过CFDA认证是无法避免的。公开资料显示,目前的医疗人工智能企业中,除了两家获得了CFDA认证的公司——武汉兰丁和EDDA科技之外,几乎所有商家都还处于免费提供试用的阶段。
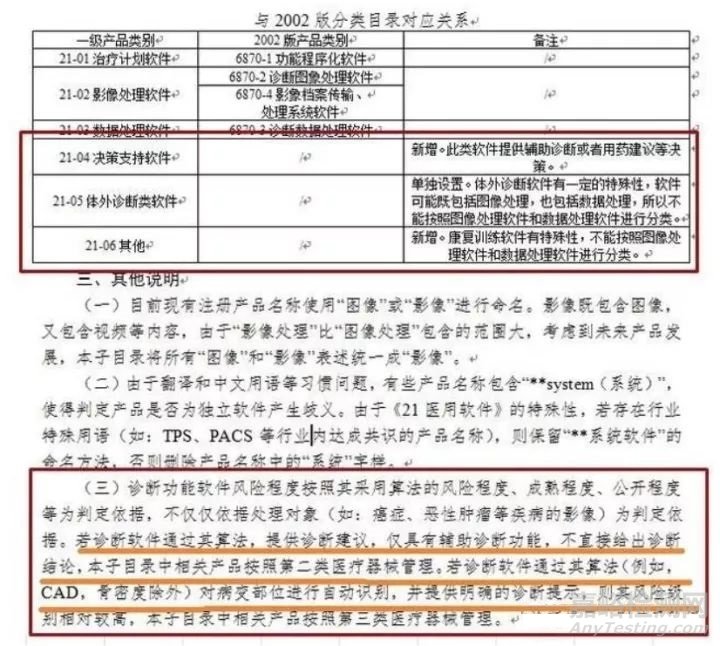
按照最新的分类规定,若诊断软件通过算法,提供诊断建议,仅有辅助诊断功能,不直接给出诊断结论,则申报二类医疗器械,如果对病变部位进行自动识别,并提供明确诊断提示,则按照第三类医疗器械管理。
值得关注的是,第三类医疗器械是需要做临床试验的,第二类器械有临床试验豁免目录,诊断软件申报是否能够享受豁免,CFDA还没有做出具体的规范。
相对于人工智能在医学影像领域的应用,人工智能在语音录入、数据结构化以及结构化后的二次应用、药物研发等领域的应用落地门槛要相对低一些。在这些应用场景中,人工智能技术只是一种工具,语音录入和数据结构化不需要进行CFDA认证,而在新药领域,有成熟的申报流程,人工智能只是加速药物的发现与临床实验,所以在这些领域,人工智能的落地要相对的容易一些。
据了解,将人工智能技术应用在这些领域的公司,大多数的付费方都是B端客户,由于不需要CFDA认证,还能大幅度提高效率,所以他们的盈利模式也容易实现。
公开资料显示,目前的医疗人工智能企业中,只有武汉兰丁和EDDA科技获得了CFDA的认证,也正因此,两家公司已经告别了免费试用的阶段,所有的客户都需要向他们支付费用。他们既可以直接将系统卖给医疗机构,也可以建立云平台向更多的医院提供服务,并在提供服务的同时获得收益。
目前大多数公司都没有拿到CFDA的认证,其中包括IBM的Watson至今仍未获得美国FDA的认证,但其服务都是在法律允许的框架之内。如今各公司都在通过将产品投入医院免费试用来积累大量临床数据,以此提高临床应用的精准度,为申报CFDA认证提供可靠的数据基础,缩小临床结果与实验室结果之间的差异。
该规范将于2018年8月1日实施,如果各个医疗人工智能公司的想要走医院采购这条路,那么获得CFDA认证是必经之路,如果要认证三类医疗器械,或者诊断类软件没有享受豁免,那么大量真实的临床应用数据将会为公司的申请提供巨大的帮助。
随着分类目录的出现,现阶段各家医疗人工智能公司在研发产品的同时理应加速CFDA认证的过程,这样在市场化过程中才可以在相对平等的条件下和器械公司、医疗机构达成合作。在具备盈利可能性的前提下,保护自己的品牌不成为别人的附庸。
拓展:各国医疗器械分类原则对比
在我国,医院医疗器械按风险等级可以分为三类,第一类是指通过常规管理足以保证其安全性、有效性的医疗器械;第二类是指对其安全性、有效性应当加以控制的医疗器械;第三类是指,植入人体;用于支持、维持生命;对人体具有潜在危险,对其安全性、有效性必须严格控制的医疗器械。这三大类也就是我们日常所说的一级、二级、三级医疗器械。
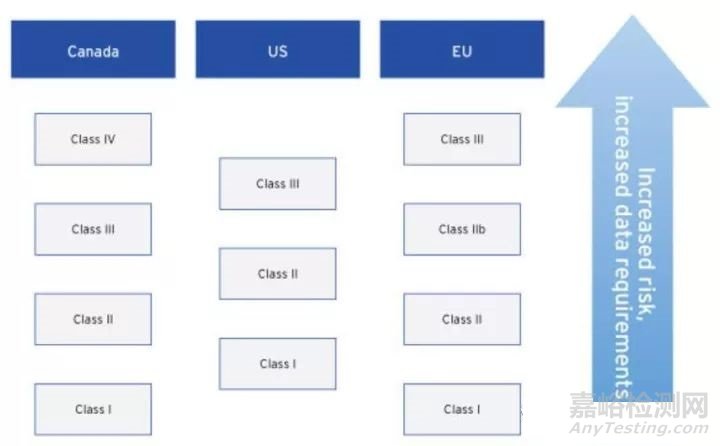
事实上,世界各国对医疗器械的等级划分都是按照risk based原则,例如美国,同样将其分为三大类:
Class 1:一般医疗器械,低危险,不容易造成人身伤害的,如绷带和牙科镜
Class 2:有一定危险的器械,如电动轮椅和避孕套
Class 3:维持生命设备,如起搏器和人造心脏瓣膜
加拿大和欧盟各成员国对等级分类更为细化,分为4个等级,出了基于风险原则,还考虑到器械的数据需求。数据需求量越大,相关细节越多,数据标准化程度越高的医疗器械等级也就越高。

来源:医疗器械创新网


