您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2018-07-06 14:24
2017年08月10日美国FDA发布了《医疗器械研发工具的认证》指导原则,提出了医疗器械研发工具(Medical Device Development Tools, MDDT)的概念,并介绍了其类型、作用和意义、认证考虑因素和认证过程。
一、MDDT的定义和类型
(一)MDDT的定义
MDDT是用于评价医疗器械有效性、安全性或性能的方法、材料或测试,需经过科学验证和FDA认证,面向大众免费开放,用于帮助医疗器械研发人员更有效地预测和评价产品性能,也用于帮助FDA更高效地做出医疗器械审评决策。指导原则里列举了三种典型的MDDT,包括临床结局评价(如脑卒中评分)、生物标记物测试(如血压计)以及非临床评价模型(如动物模型)等。
图一:三种典型的MDDT
(二)MDDT的类型
1.临床结局评价(Clinical Outcome Assessment, COA)
COA包括患者、医生、观察者报告结局及功能测试结局,通常采用评级或评分的形式。COA不仅包括测量方法,还包括使用说明、数据收集标准格式以及对目标人群结果评分、分析和解释的方法等。常见的COA包括:
(1)患者报告结局(Patient-reported outcome, PRO)
PRO是未经医生或其他人修正或解释的由患者报告的健康状况结局。患者自身才能感知的某些症状(如疼痛或恶心严重程度)只能通过PRO进行评价,另外,PRO也用于评价患者的功能或活动能力。
(2)观察者报告结局(Observer reported outcome, ObsRO)
ObsRO由父母、医护人员或其他病患观察者报告,不包含临床判断和解释,适用于婴儿或者有认知缺陷的人,例如父母对婴儿呕吐发作的记录报告。
(3)医生报告结局(Clinician-reported outcome, ClinRO)
ClinRO包含了医护人员观察到的患者症状、行为和功能障碍以及对此进行的临床判断和解释。
(4)功能测试结局(Performance outcome, PerfO)
PerfO是患者在专业医护人员的指导下完成功能测试得到的报告结局,例如反映患者认知能力的数字符号替换测验(Digit Symbol Substitution Test)等。
2.生物标记物测试(Biomarker Test, BT)
BT是检测生物标记物的方法或仪器,例如血压计、血清蛋白测试方法、影像学检测肿瘤尺寸等。生物标记物是显示生理状态、病理状态或者医疗干预效果的客观检测指标。常见的生物标记物包括生化分子、组织病理学特征、放射学影像特征等。生物标记物可分为:患病风险预测类生物标记物、诊断类生物标记物、监测类生物标记物、预后生物标记物、暴露因素效应预测类生物标记物、药代动力学生物标记物、安全类生物标记物。
生物标记物测量可在器械研发和评价中提供量化数据,可在临床试验中帮助筛选符合入选标准的病例,也可被用来明确治疗性器械的安全性或揭示医疗干预的作用。
3.非临床评价模型(Non-clinical Assessment Model, NAM)
NAM可以是体外模型、离体组织模型、动物模型或计算机模型,用于测量或者预测相关参数。
二、MDDT认证的考虑因素
完整的MDDT内容应至少包含基本信息描述(例如MDDT名称、种类和工作原理等)、使用环境、支持MDDT认证的证据、风险受益评估等四个方面,后三者是影响MDDT认证决策的主要因素。
(一)MDDT的使用环境(Context of Use, COU)
使用环境是MDDT认证的重要内容,MDDT在相应的使用环境下方具有权威性和科学性。使用环境描述了MDDT正确的使用范围、方式和作用。以2017年10月19日FDA公布的第一个经过认证的MDDT——堪萨斯城心肌病患者生存质量量表(Kansas City Cardiomyopathy Questionnaire,KCCQ)为例,完整的COU应包括以下内容:
1.MDDT应用的领域:KCCQ的COU明确其用于心力衰竭患者健康状态评分;
2.MDDT具体的测量输出:KCCQ的测量输出包含心力衰竭症状评分、生活质量评分、身体活动受限评分和综合评分等;
3.MDDT在器械审评过程中的作用:在临床试验中,MDDT可用于确认目标人群、适用症、入排标准、研究终点等;
4.MDDT适用的医疗器械研发阶段:对于KCCQ,其可以作为相关器械可行性临床试验或关键临床试验的主要/次要评价指标。
(二)支持MDDT认证的证据
证据资料通常包含设计验证资料、计算机模拟结果、台架试验数据、动物试验数据、临床试验数据(阐述MDDT与其使用环境之间的关系)、人机因素和/或文献分析等。申请人必须解释证据如何支持MDDT在相应使用环境下的有效性、预测能力和预测捕获程度。
1.有效性
MDDT精准测量的能力。根据不同的MDDT,证据可包含分析型数据、临床数据、结构效度、外部效度、偏倚减少控制、本构模型验证、数值收敛性、不确定性量化等类型数据。
2.预测能力
用来描述MDDT测量与结局之间的相关性。
3.预测捕获程度
MDDT捕获真实结局总效应的能力,数据应能反映器械各个方面的主要效应。
MDDT认证需要的证据强度和数量取决于不同的MDDT种类及其不同的使用环境。相比表征不良反应的MDDT,监测临床试验终点指标的MDDT的认证显然需要更强的证据支持。对于首个被认证的KCCQ,其申请资料既对已有文献数据进行汇总分析,也将KCCQ方法与其它心力衰竭评价方法(例如NYHA分类)进行比对分析,这些证据支持其准确性和稳定性,而内部一致性和重测信度分析则支持该工具的可靠性。
(三)MDDT的风险受益评估
MDDT的受益分析应考虑受益的种类、大小以及实现的可能性。例如某些MDDT可以提高器械研发和审评的速度,缩短临床试验时间、减小临床试验规模或替代临床试验。在受益程度方面,FDA会优先考虑可用于多种器械研发的MDDT,对严重影响生存质量或危及生命的疾病,临床需求未被满足的人群(例如儿童),以及尚未建立评价方法的创新产品等领域的MDDT都是优先考虑的对象。
MDDT风险分析需要考虑风险种类、大小以及发生的可能性,例如使用本不应被认证的MDDT促成的决策会带来何种风险,MDDT不准确的输出对决策造成的影响大小,BTs产生假阳性/假阴性结果的可能性大小等均需被考虑。另外,还需考虑可采取的风险控制措施,例如使用补充数据或验证性数据可能会降低单独依靠MDDT做决策时的风险。
FDA重点关注MDDT对器械审评、公众健康和临床的影响。需要强调,准确性、精确性、预测能力或预测范围并不能单一地用于评价MDDT的优劣,整体的利弊权衡才是决定是否接受MDDT的考虑因素。如果MDDT的预期优势很小,或潜在的劣势较大,认证时则需要更严格的证据。
三、MDDT的认证过程
MDDT的认证过程包含提案、孵化(非强制)、预认证(非强制)、认证等四个阶段(图二)。提案阶段便于FDA根据自身人力资源情况和MDDT意义大小决定是否接受认证申请。孵化阶段便于FDA参与MDDT前期认证准备工作。在预认证阶段,申请人提交申请资料以便FDA提出改进建议。在认证阶段,FDA根据申请人提交的申请资料最终决定是否接受MDDT的认证。
影响MDDT认证是否通过的主要因素包括MDDT描述是否详细充分、使用环境定义是否明确恰当、产品是否具有广泛的公众健康影响力、证据强度是否足够、受益是否大于风险等。
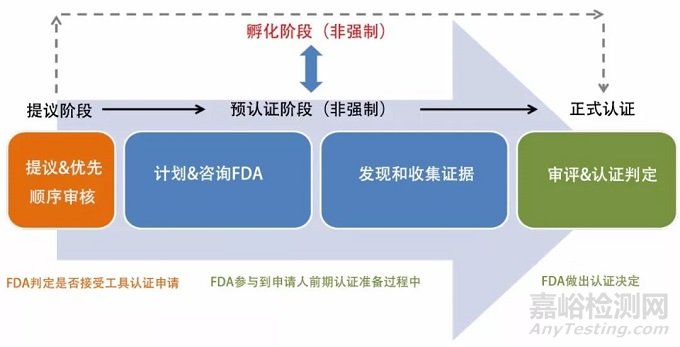
图二:MDDT的认证过程
四、MDDT的作用和意义
医疗器械研发人员可以免费获取并使用MDDT,一个MDDT可应用于多种器械研发和评价过程中。在相应的使用环境下FDA不需重复确认该MDDT的科学性和适用性,因此既可加快器械的研发速度,也可提高监管机构的审评审批速度。
在进行MDDT认证时,FDA将优先考虑用于解决公共健康需求的MDDT。例如严重影响患者生存质量或危及生命的疾病相关MDDT,临床需求急需被满足的儿科相关MDDT,以及可以用于尚未建立方法的创新产品评价的MDDT等。
MDDT不用来替代标准和指导原则。标准通常是被广泛认可的较为成熟的技术方法,MDDT则涉及前沿领域或创新器械的评价方法。指导原则对某一种器械提出系列评价方法,而MDDT聚焦于一种评价或测量方法,可用于多种不同器械的评价。另外,FDA鼓励不同个体或团体针对共同关注的MDDT形成合作,从而集中资源发展MDDT。因此,MDDT能对标准、指导原则等技术文件形成一种有力的补充。

来源:中国器审