您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-12-20 18:20
一、基本概况
1、自然环境
泰国位于中南半岛中南部。与柬埔寨、老挝、缅甸、马来西亚接壤,东南临泰国湾(太平洋),西南濒安达曼海(印度洋),属热带季风气候,全年分为热、雨、凉三季,年均气温27℃。
2、人口和行政区划
泰国总人口为6790万人。全国共有30多个民族。泰族为主要民族,约占人口总数的40%,其余为老挝族、华族、马来族、高棉族等。泰语为国语。90%以上的民众信仰佛教,约5%的民众信仰伊斯兰教。
泰国全国分中部、南部、东部、北部和东北部五个地区,共有77个府,府下设县、区、村。首都为曼谷(Bangkok),曼谷是唯一的府级直辖市。各府府尹为公务员,由内政部任命。曼谷市长由直选产生。
3、2024年出口概况
2024年1-10月,中国向泰国出口医疗器械总计约56.56亿人民币,同比增加8.29% 。
二、泰国医疗器械监管机构和法规要求
泰国食品和药物管理局(Thai FDA,TFDA)负责泰国的医疗器械产品注册。TFDA的医疗器械控制部门(MDCD)专门负责监督医疗器械的法规相关事务。
当地的主要法规为Medical Device Act B.E. 2551 (2008)和Medical Device Act (2nd Edition) B.E. 2562 (2019) 。另外作为东盟ASEAN成员国,泰国也会参考东盟相关法规。
三、医疗器械定义
◆ 医疗器械
1. 指在实验室内外使用的任何仪器、器具、机器、植入物、体外试剂、材料、软件或相关物品,由制造商或产品所有人打算单独或组合用于人类或动物:
a. 诊断、预防、监测、治疗或减轻人类或动物疾病;
b. 诊断、监测、治疗或赔偿人类或动物的伤害;
c. 调查、替换、修改或支持人体或动物的解剖或生理过程;
d. 支持或维持人体或动物的生命;
e. 控制受孕或帮助人体或动物的繁殖;
f. 帮助或补偿人体或动物的残疾;
g. 透过体外检验源自人类或动物的样本,为医疗诊断目的提供资料;
h. 消毒医疗器械。
2. 与第“1.”项下的医疗器械一同使用的附件;或
3. 部长通知规定作为医疗器械的其他仪器、工具、机械装置产品或物体。
注:第“1.”项所述产品应不是通过药理学、免疫学或新陈代谢的方式在人类或动物体内实现其主要预期作用。
◆ 体外诊断医疗器械
指的是任何试剂、试剂产品、校准品、质控品、试剂盒、仪器、装置、设备或系统,无论是单独使用还是与其他试剂、试剂产品、校准品、质控品、试剂盒、仪器、装置、设备或系统组合使用,由其产品所有者预期用于体外检查来自人体的任何样本,包括任何血液或组织捐赠,主要用于提供以下信息:
1. 有关生理或病理状态或先天性异常的信息;
2. 确定任何血液或组织捐赠与潜在接受者的安全性和相容性;
3. 监测治疗措施,包括样本容器。
四、产品分类
1. 分类依据:东盟医疗器械指令AMDD(附件2:非IVD医疗器械分类规则;附件3:IVD医疗器械分类规则)
2. 分类
泰国分类为Class 1~4,对应AMDD的Class A~D。
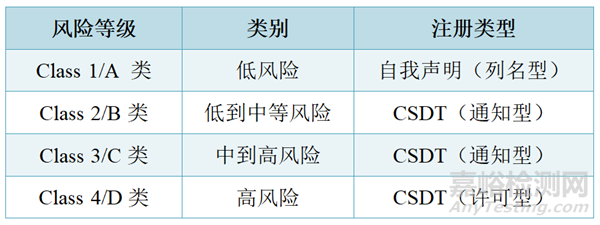
除此之外,法规中还包含分组规则,根据法规医疗器械分组有六类:单品(Single)、系统(System)、家庭 (Family)、套装 (Set)、诊断试剂盒(IVD Test Kit)、体外诊断产品(IVD Cluster)
五、注册流程
1、产品注册流程
◆ 确定产品分类
◆ 选择注册途径
◆ 委托代理人(如果需要):如果制造商位于国外,通常需要委托泰国的注册代理商协助申请过程。(泰国当地代理(establishment registrant),这一角色可以是自然人也可以是法人。而代理人在代表境外制造商办理相关医疗器械注册手续前,应先申请Establishment licence for importing,取得相应证照后,才能向TFDA提交注册申请,产品的注册证亦由代理人持有)
◆ 准备技术文件:制造商需要准备详细的技术文件,包括产品描述和规格、设计和制造过程的详细描述、材料和成分的清单、质量管理体系的描述、风险评估和管理、临床数据(如果适用)等。
◆ 提交注册申请:通过TFDA电子系统提交产品注册申请,包括所有必要的文件和信息。这包括填写申请表、上传准备好的技术文件和符合性声明,以证明设备符合TFDA的要求,并缴纳注册费用。
◆ 审核和批准:TFDA会对提交的文件和产品信息进行审核,以确保符合所有相关法规和标准。文件审查过程中,如果文件有任何遗漏或需要进一步澄清,TFDA会要求申请人提供额外的信息或文件。
◆ 获取注册证并销售:获得TFDA的注册批准后,医疗器械将被列入泰国的注册数据库,制造商或授权代表可以合法地在泰国市场销售该产品。
一旦获得批准,所有类型的注册许可证有效期为5年。
2、泰国医疗器械三种注册路径
①全面评估(Full Evaluation)
1. 要求在泰国生产或进口用于商业用途的医疗设备需要获得以下许可:生产或进口的经营许可,任何打算从事医疗设备制造或进口的人都必须向TFDA完成企业注册程序;生产或进口的产品注册,一旦获得营业执照作为先决条件,制造商或进口商必须启动产品注册程序。
2. 医疗设备注册过程
将医疗设备分类到特定的风险类别中;
申请人必须提交申请以及必要的文件和适当的审查费用,具体费用取决于设备属于列名型、通知型或许可型哪个类别,每个类别都有自己相应的费用结构。
根据不同类别,申请人需按照法律规定及部长条例准备相应的文件。
②简洁途径(Concise Pathway)
是指一种认可参考机构批准的医疗设备注册方法,该途径旨在加快注册过程并降低评估费用。资格标准为:
1. 适用于Class 2、3、4类的器械;
2. 医疗设备必须通过以下至少1个机构的注册并上市超过一年且未发生任何严重不良事件,6个参考机构包括:
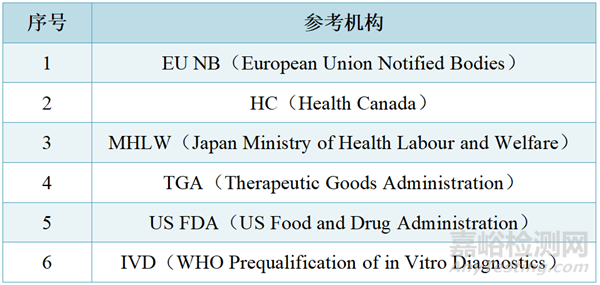
3. 通过简明途径提交的医疗器械的商品名称、型号、产品代码、用途、标识、标签、使用说明、包装、实体制造商名称和地址必须与参考机构批准的相同。
③信赖计划(Reliance Program)
信赖计划是一项医疗器械注册计划,依赖于新加坡卫生科学管理局(HSA)的批准,该计划旨在加快注册过程并降低评估费用。资格标准为:
◆ 适用于Class2、3、4类医疗器械;
◆ 通过新加坡卫生科学管理局(HSA)的批准;
◆ 通过信赖计划途径提交的医疗器械的商品名称、型号、产品代码、预期用途、适应症、标签、使用说明书(IFU)、包装、实体制造商的名称和地址必须与新加坡HSA批准的相同。
3、注册提交技术文件
全面评估要求医疗器械注册资料按照CSDT格式准备。
通用提交档案模板 (详见AMDD附件4,“ANNEX 4 ASEAN Common Submission Dossier Template”),CSDT相当于简化版的技术文档,在注册递交时,跟申请表一起递交给监管机构。
CSDT技术文件主要包括:
◆ 执行摘要 Executive Summary
◆ 证明符合性的基本原则和方法 Relevant Essential Principles and Method Used to Demonstrate Conformity
◆ 医疗器械说明 Medical Device Description
◆ 设计验证和确认文件摘要 Summary of Design Verification and Validation Documents
◆ 医疗器械标签 Medical Device Labelling
◆ 风险分析 Risk Analysis
◆ 制造商信息 Physical Manufacturer Information
低风险的普通Class 1类设备必须在泰国进口和销售之前列名,而Class 2类和3类设备必须先通过文件预审,Class 4类设备必须获得批准的许可证才能投放泰国市场。
Class 2、3和4类器械需要按照东盟CSDT格式提交技术档案。Class 1类无菌和测量设备需要提交测试报告才能将这些设备投放市场。


4、注册周期及费用
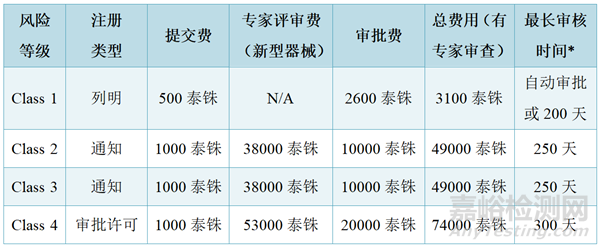
汇率换算:1 美元 ≈ 34.54 泰铢
5、注册提交流程
◆ 电子系统提交
注册账号:制造商或授权代表需要在泰国TFDA电子系统(e-submission)中注册账号,以便在线提交产品注册申请。注册账号时需要提供公司基本信息和授权人员的信息。
6、现场审核要求及注意事项
◆ 生产环境
要求:生产环境应符合卫生和安全标准,包括清洁、控制污染和环境监测。
设备维护:生产设备应定期维护和校准,确保其性能稳定。
◆ 质量管理体系
ISO 13485:制造商应持有ISO 13485认证,并在实际操作中遵循质量管理体系的要求。
记录保存:生产过程中的所有记录,包括质量控制记录、设备维护记录、培训记录等,必须妥善保存。
◆ 生产过程
控制:应有明确的生产控制程序,包括原材料的检验、生产过程的控制、产品的最终检验等。
人员培训:生产人员应接受充分的培训,并掌握必要的操作技能。
◆ 文件和记录
完整性:所有与生产相关的文件和记录应完整、准确、可追溯。
更新:确保文件和记录保持最新状态,并符合TFDA的要求。
7、该区域有关UDI的要求
目前无强制要求
其他注意事项或特别提醒
许可证转让
1、哪些情况下需要转让医疗器械许可证?
1. 注册人(进口商或制造商)变更
当负责进口或制造的注册实体发生变更时,必须进行许可证的转让。这通常出现在企业所有权或管理权发生转移,或公司希望更换正式注册人的情况下。
2. 品牌名称变更
如果医疗器械以新的品牌名称进行销售,需办理许可证转让,以确保新品牌继续符合此前批准的合规标准。
3. 公司合并或收购
在公司合并或收购的情况下,获得所有权的一方需办理许可证转让,以确保反映最新的所有权变更。
4. 产品一致性
许可证转让仅适用于在规格、用途、制造工艺和标准控制等方面与原产品完全一致的情况。如果产品在任何方面发生重大变更,则需重新申请新的许可证。
2、泰国医疗器械许可证转让的操作流程?
1. 文件审核与同意
原许可证持有人需提供书面同意文件,授权新注册人使用相关资料。此同意必须以正式信函形式提交。
2. 提交产品一致性声明
新注册人需提交“产品一致性声明”,确认该医疗器械在制造工艺、用途等各方面与原产品完全一致。
3. 安全证书
需提供来自制造商或产品所有人的安全证书,证明医疗器械依然符合所有相关安全标准。
4. TFDA注册状态检查
原注册证书必须保持有效,不能过期或被撤销,以确保产品在转让后依然合规。
5. 审批与转让
TFDA将审核所有提交的文件,审核通过后,许可证转让正式获批,新注册人将承担医疗器械的注册和合规责任。
泰国的医疗器械许可证转让申请可以分为:完整或部分申请。
1. 完整申请:TFDA 认为完整申请完全符合当前的监管标准,包括完整的递交文件,比如符合性声明、授权书和安全声明。作为完整申请处理的许可证转让通常需要之前的许可证持有人提供较少的其他文件,从而简化了转让流程。
2. 部分申请:部分申请并不符合全部的现有监管标准,可能仍是按照以前的规定进行提交。对于这些情况,现有许可证持有人必须通过提交其他文件来确保合规性,从而将部分申请升级为“完整申请”状态。
3、新加坡信赖路径申请并转让的注意事项
对于通过信赖路径批准的医疗器械,TFDA 仍然要求完整申请才能获得转让资格。转让申请必须包括初始申请中的所有文件,确保新注册人收到所有的相关记录,包括批准后提交的任何变更或通知。
许可证的取消和重新颁发
许可证成功转让后,TFDA会颁发新的许可证编号,而之前的许可证将会失效。之前的许可证持有人必须在批准转让后30天内正式注销其许可证。这项规定至关重要,因为它确认了所有的监管责任目前都落在新的许可证持有人身上。
TFDA的审核时间
尽管 TFDA 计划通过绕过专家审查来加快转让申请,但申请人应为整个转让过程(包括提交和审批)预留大约两个月的时间。尽管转让的审批协议经过简化,但时间表与标准的 TFDA 注册申请审核还是保持一致的。
注册变更
1、泰国的医疗器械注册变更可以分为三种类型:
1. 不影响医疗器械安全性的微小变更
2. 需要评估技术文件的微小变更(Minor Change)
3. 需要评估技术文件的重大变更(Major Change)
1. 微小变更
这类不影响医疗器械安全性能的微小变更可以直接在电子系统上提交申请,附上变更文件,TFDA会自动审批,不会收取变更费用,包括有:
a) 没有影响医疗设备性能或安全的标签或文件变化。比如,颜色变化,添加/取消/改变图片格式,条形码符号,或文本的无效变化;
b) 以增加使用医疗器械的安全性的标签或文件变更,如增加或更改警告、警示、禁止和/或不适用的症状;
c) 仍然是同一医疗器械的产品代码变更,仅更改产品代码,例如修改产品代码以指示分销区域;
d) 因拼写错误修改医疗器械或附件列表的变更;
e) 以及其他变更。
2. 需要评估技术文件的微小变更(Minor Change)
这类变更需要TFDA进行文件评估,会收取变更费用及评估费用,处理时间为5个工作日,包括:
a) 增加/减少/更改医疗器械灭菌场所,但灭菌过程不改变;
b) 增加/减少同一医疗器械组中的医疗器械清单,不影响医疗器械分组;
c) 变更医疗器械制造商(Physical manufacturer),但仍拥有原产品(Legal manufacturer/Product owner);
d) 产品所有者的名字或地址变化,而不改变国外制造商的地址;
e) 国外制造商名称变化,而不改变地址;
f) 缩短使用寿命或提高保质期;
g) 不影响医疗器械的性能或安全性,医疗器械的标签或文档变化;
h) 医疗器械的标签或文件变化,以增加医疗器械使用的安全性;
i) 产品代码,仍然是同一个医疗器械;
j) 软件变更(仅限不影响医疗器械性能和安全的变更);
k) 以及其他变更。
3. 需要评估技术文件的重大变更(Major Change)
这类变更更需要TFDA进行文件评估,会收取变更费用及评估费用,处理时间为35个工作日,包括:
a) 风险类型仅适用于Class 2和3类,不影响优先级的变化;
b) 指示/预期用途;
c) 请求修改医疗器械的关键组件(主要成分)产品规格;
d) 医疗器械的具体要求;
e) 延长使用寿命或降低保存强度;
f) 主要包装的变更;
g) 影响医疗器械性能和安全的生产过程;
h) 以及其他变更。
2、变更流程
◆ 变更申请
提交申请:向TFDA提交正式的变更申请,包括详细的变更描述和相关文件。
申请表格:填写TFDA要求的变更申请表格,准确描述变更内容和理由。
◆ 文件要求
技术文档:提供更新后的技术文档、设计变更说明、验证和确认记录。
测试报告:如有新设计或生产工艺的变更,需提供相关的测试和验证报告。
◆ 审查过程
初步审查:TFDA对变更申请进行初步审查,确认材料的完整性和准确性。
技术审查:对变更内容进行技术评估,确保其不会影响产品的安全性和有效性。
现场检查:如变更涉及生产工艺或设施,TFDA可能要求进行现场检查。
◆ 变更批准
批准通知:变更审核通过后,TFDA将发出正式的批准通知,确认变更的有效性。
证书更新:如变更影响到注册证书的内容,TFDA将更新注册证书。
注册豁免
根据泰国医疗器械法规(MEDICAL DEVICES ACT, B.E. 2551 (2008))第27条规定,满足注册豁免的医疗器械有:
1. 国家机构及泰国红十字会为预防、诊断、治疗疾病或康复目的而制造、进口或销售的医疗器械;
2. 根据《医疗机构法》,专门为医疗机构消毒而制造的医疗器械;
3. 医疗及公共卫生人员为个别患者或动物制造或销售的医疗器械;
4. 制造、进口符合自用、样品、展览或者质量、标准的研究、分析、检验需要一定数量的医疗器械;
5. 为特定个体患者或动物而进口的医疗器械;
6. 制造供出口的医疗器械样品;
7. 根据部长通知规定的规则、程序和条件以及委员会的建议制造或进口的医疗器械。
销售许可
在泰国,部分产品在取得牌照和产品注册后,在销售阶段仍需要办理销售许可才允许销售。
需要办理销售许可的产品:
1. 植入式硅胶乳房假体;
2. 牙齿美白装置;
3. 眼科内脏外科器械(OVD);
4. HIV检测包;
5. 血袋;
6. 注射透明质酸真皮填充剂。

来源:广东省医疗器械管理学会


