您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-11-25 09:27
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:16条资讯,阅读时长约:3分钟 」
今日头条
复宏汉霖公布其曲妥珠单抗生物类似药Ⅲ期研究结果。在2019欧洲肿瘤内科学会亚洲年会(ESMO-Asia 2019)大会上,复宏汉霖曲妥珠单抗生物类似药HLX02公布其治疗HER2+复发或未经治疗的转移性乳腺癌的国际Ⅲ期临床的积极结果。HLX02在24周时的总体缓解率为71.0%,原研药曲妥珠单抗(EU-TZB)为71.4%;HLX02和EU-TZB的所有次要终点,包括第6、12和18周的总体缓解率、临床获益率、疾病控制率、缓解持续时间、无进展生存期以及第24周的总体生存期均相似;其中,HLX02组的疾病控制率为83.0%,EU-TZB组的疾病控制率为84.3%;HLX02的中位无进展生存期为11.7个月,而EU-TZB为9.69个月。
国内药讯
1.上海医药布洛芬缓释胶囊通过一致性评价。上海医药旗下布洛芬缓释胶囊(0.3g)通过仿制药一致性评价并获国家药监局颁发的《药品补充申请批件》。布洛芬缓释胶囊主要用于缓解轻中度疼痛,以及普通感冒或流行性感冒引起的发热。该药原研药由葛兰素史克研发,最早于1988年在约旦上市。目前,国内该药品的主要生产厂家有上海爱的发制药、中美天津史克、润都制药和联邦制药等。2018年该药品医院采购金额为人民币6,107.73万元。
2.新华制药卡托普利片通过一致性评价。新华制药卡托普利片(25mg)获国家药监局核发的《药品补充申请批件》,成为该品种国内第三家通过一致性评价的产品。卡托普利片为抗高血压药,属于ACE抑制剂,主要用于治疗高血压和心力衰竭。该药原研药为百时美施贵宝的卡托普利片,最早于1981年获FDA批准上市。目前,该产品国内已获批的企业包括中美上海施贵宝、新华制药、旭东海普药业、罗欣药业等。
3.百济神州合作HER2双抗最新数据公布。百济神州合作伙伴Zymeworks公司在ESMO-Asia 2019会议上,公布其HER2双特异性抗体ZW25的治疗HER2表达实体瘤的Ⅰ期临床数据。在胆管癌、直肠癌和胃癌等10多种实体瘤患者中,在接受ZW25的每周10mg/kg或每两周20mg/kg初始剂量情况下,在可评估的57例病例中有25例得到部分响应,客观响应率达43.9%,其中15例病例疾病稳定至6个月以上,疾病控制率达到70.2%。此外,ZW25最常见的治疗相关不良事件均为1级或2级,耐受性良好。百济神州通过授权拥有其在亚洲(除日本外)、澳大利亚和新西兰的独家开发和商业化权利。
4.丽珠单抗重组抗IL-17A/F单抗临床申请获受理。丽珠单抗与鑫康合生物联合申报的“重组抗人IL-17A/F人源化单克隆抗体注射液”临床申请获国家药监局受理。重组抗人IL-17A/F人源化单克隆抗体注射液通过阻断IL-17A/F及其下游通路相应受体的相互作用,此次申请拟用于中重度斑块型银屑病、强直性脊柱炎等自身免疫相关的适应症。针对IL-17A靶点:国内已有Cosentyx(可善挺)、TALTZ(拓咨)两个进口产品获批上市。国产共有5家企业已获批临床。针对IL-17A/F靶点:目前全球尚未有该靶点的产品上市,国内暂无其他公司申报临床。
5.腾盛博药引进7款抗感染在研疗法。腾盛博药与美国An2 Therapeutics、Qpex Biopharma、Artizan Biosciences等三家公司达成合作,共同开发和商业化7种新型抗感染疾病药物。根据协议:腾盛博药将在大中华区开发、制造和商业化An2公司的一款靶向结核病菌感染的临床阶段的新型广谱抗生素;在中国开发和商业化Qpex公司的静脉输注β-内酰胺酶抑制剂(BLI),超广谱口服β-内酰胺酶抑制剂(BLI)以及一类静脉输注的合成多粘菌素;获Artizan公司授权,在其专有IgA-SEQ™技术平台开发的拟用于治疗肠道炎症及细菌感染的产品组合中,推进3个项目在中国的开发和商业化。据悉,腾盛博药对上述公司进行了股权投资。
国际药讯
1.癫痫创新疗法获FDA批准。SK Life Sciences公司开发的Xcopri(cenobamate tablets)获FDA批准上市,在成人中治疗局灶性癫痫。在两项临床研究中,癫痫发作频率为8.5次/28天的患者接受不同剂量的Xcopri或安慰剂的治疗。试验结果表明,与基线水平相比,不同剂量的Xcopri将患者癫痫频率分别降低36%(100 mg),55%(200 mg)和55%(400 mg),安慰剂组这一数值为24%。Xcopri的推荐维持疗法剂量为200 mg/天。
2.阿斯利康BTK抑制剂获三国同时批准。阿斯利康(AstraZeneca)开发的BTK抑制剂Calquence(acalabrutinib)获FDA批准,作为初始疗法或后续疗法,治疗慢性淋巴性白血病(CLL)或小细胞淋巴瘤(SLL)成人患者。此次批准是在FDA实时肿瘤学审评(RTOR)试点项目下完成,并依据FDA的Orbis计划,澳大利亚和加拿大的药监部门也同时对这一申请进行了审评,同时批准了这一申请。两项Ⅲ期临床结果显示,与标准疗法相比,Calquence的单药疗法和联合疗法,能够显著延长患者的无进展生存期。
3.Alexion补体C5抑制剂新适应症获日本批准。日本厚生劳动省批准Alexion公司补体C5抑制剂Soliris(eculizumab)的一个新适应症,用于治疗抗水通道蛋白-4(AQP4)抗体呈阳性的视神经脊髓炎谱系障碍(NMOSD,包括视神经脊髓炎)患者,预防病情复发。一项在抗AQP4自身抗体阳性NMOSD患者中开展的III期临床PREVENT数据显示,与安慰剂相比,Soliris将疾病复发风险显著降低94.2%(p<0.0001);治疗第48周时,Soliris治疗组有97.9%的患者没有复发,安慰剂组比例为63.2%。Soliris目前已获批治疗4种罕见病:阵发性睡眠性血红蛋白尿(PNH)、非典型溶血尿毒症综合征(aHUS)、抗AchR抗体阳性重症肌无力和NMOSD。
4.BioMarin血友病基因疗法在欧盟申报上市。致力于开发孤儿药的BioMarin公司向欧洲药品管理局(EMA)递交其基因疗法valoctocogene roxaparvovec用于治疗严重成年A型血友病的上市申请。BioMarin预计将为其使用EMA的加速评估通路。Valoctocogene roxaparvovec是一种使用AAV5病毒载体递送表达因子VIII的转基因的基因疗法。该疗法已获FDA授予的突破性疗法认定和欧盟授予的PRIME药品认定,以及EMA和FDA授予的孤儿药资格。一项Ⅰ/Ⅱ期临床中,A型血友病患者接受该基因疗法一次治疗后,其第3年的年出血率(ABR)和使用因子VIII的需求持续得到控制。治疗期间,ABR和因子VIII使用率都平均下降96%。患者不再需要预防性因子VIII注射。BioMarin还计划在年底向FDA递交其上市申请。
5.全球首款男性避孕针剂完成临床试验。印度医学研究理事会完成注射式男性避孕药的Ⅲ期临床,并已向印度药物监督管理局递交其上市申请。据悉,该款避孕产品是一款可逆性精子抑制剂(RISUG),主要由合成聚合物苯乙烯马来酸酐组成。在此次公布的Ⅲ期临床结果显示,所招募的303例志愿者避孕成功率为97.3%,无副作用报告,注射后针剂的有效期长达13年,且这一注射可以通过破坏凝胶的第二次注射来逆转节育情况。RISUG最快6个月后获批上市,有望成为全球首款注射式男性避孕药。
6.艾伯维与Harpoon 公司达成合作协议。艾伯维与Harpoon公司就Harpoon公司的靶向B细胞成熟抗原(BCMA)的在研T细胞结合器HPN217达成独家许可协议。Harpoon计划今年递交HPN217治疗多发性骨髓瘤(MM)患者的IND申请。根据协议,Harpoon将负责开发HPN217至Ⅰ/Ⅱ期临床阶段;艾伯维享有HPN217的独家选择权益,将负责HPN217的进一步开发、制造和推广活动;Harpoon将获得总计高达5.1亿美元的预付款和潜在里程碑付款以及HPN217未来的销售额分成。此外,艾伯维有权获取另外6个靶向其它靶点的TriTAC(Tri-specific T细胞激活构建体)分子。对于每个分子,Harpoon可能获得高达3.1亿美元的前期和里程碑付款。
医药热点
1.两院新增选院士名单公布。中国科学院和中国工程院同一天分别公布了2019年新增选的中国科学院院士和中国工程院院士名单。据悉,2019年中国科学院选举产生了64名中国科学院院士和20名中国科学院外籍院士。其中,生命科学和医学学部共有山东大学陈子江、清华大学董晨等10名新当选院士。2019年中国工程院共选举产生75位院士和29位外籍院士。其中,医药卫生学部共有中国人民解放军军事科学院军事医学研究院陈薇、温州医科大学李校堃、澳门科技大学刘良等10名新当选院士。
2.2018年巴西抗生素消费率美洲最高。世卫组织近日公布的一项调查报告显示,在所调查的65个国家和地区中,抗生素消费率平均每1000名居民每日用量最低4剂,最高为64剂。在所分析美洲国家和地区中,巴西的抗生素消费率排名第一,平均每1000名居民每日用量为22.75剂。紧随其后的是玻利维亚(19.57剂),之后依次是巴拉圭(19.38剂)、加拿大(17.05剂)等。世卫组织就抗生素过度使用发出警告。据悉,抗生素的不当使用会导致细菌产生耐药性,全球每年死于耐药性疾病的患者约有70万人,预计该项数据将在2050年增至1000万人。
3.医保电子凭证上线。国家医保局11月24日宣布上线医保电子凭证,市民可上国家医保APP或支付宝等激活领取。医保电子凭证可直接用于医院看病、药房购药结算,忘带实体卡也不怕。据介绍,医保电子凭证安全可靠,目前首批河北、吉林、黑龙江、上海、福建、山东、广东7省市已经可以激活领取医保电子凭证,济南、福州、厦门等20个城市的部分药店和医院已经开通医保支付功能。未来将推广至全国,并实现跨省就医互通。
4.新一轮大型医院巡查启动。《大型医院巡查工作方案(2019~2022年度)》发布,自今年11月起,将针对二级以上公立医院进行巡查,重点集中在公立医院党建、行业作风建设和运行管理3个方面。针对医院运行管理,拟重点巡查执行国家医疗管理规章制度的执行情况。如,进一步改善医疗服务行动计划的各项要求落实情况,绩效考核制度实施的工作情况,远程医疗服务开展工作情况等。同时,将重点巡查预算管理制度执行情况、法律法规落实情况,以及审计制度建立健全并有效实施工作。
【现代制药】控股子公司天伟生物注射用米卡芬净钠通过注册审批,注射用米卡芬净钠最早于2002年在日本上市,2005年通过美国FDA认证,2006年在中国获批,用于治疗由曲霉菌和念珠菌引起的真菌血症、呼吸道真菌病、胃肠道真菌病。
【宜华健康】(1)全资子公司达孜赛勒康终止收购义乌市三溪堂国药馆连锁有限公司、义乌三溪堂中医保健院有限公司、义乌市三溪中医药研究所各65%股权。(2)终止新疆维吾尔自治区人民医院特许经营及相关资产转让协议。
【辰欣药业】股东遵义乾鼎因短线交易收到上交所监管函。
审评动向
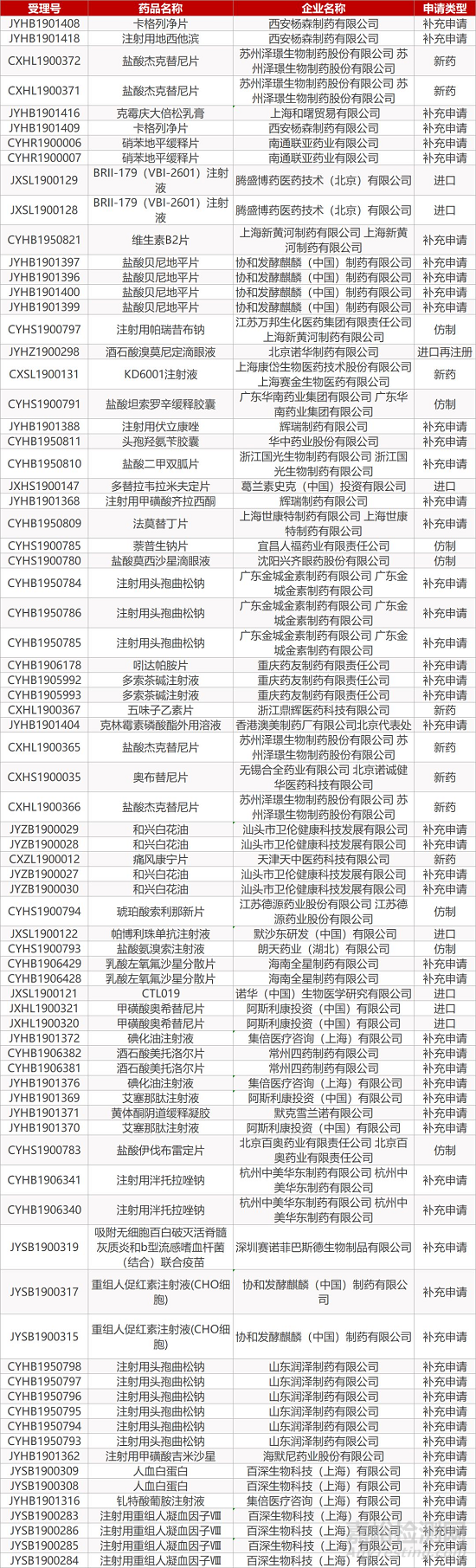
1. CDE最新受理情况(11月24日)
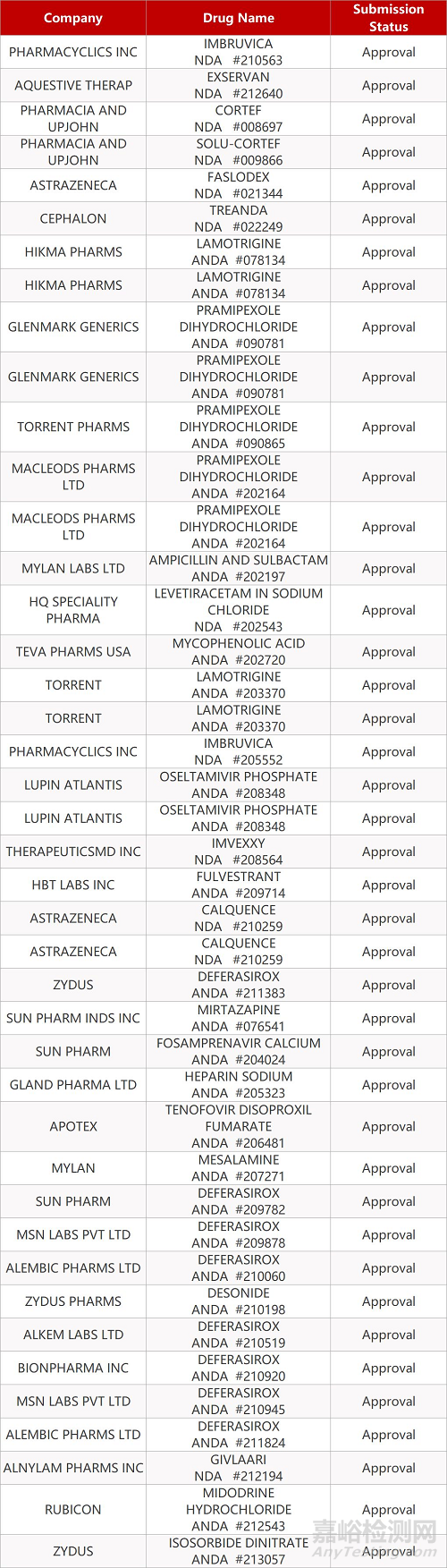
2. FDA最新获批情况(北美11月23日)

来源:药研发


