您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-01-08 09:04
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:16条资讯,阅读时长约:3分钟 」
今日头条
真实世界证据支持药物研发与审评的指导原则发布。为进一步指导和规范真实世界证据用于支持药物研发和审评的有关工作,保障药物研发工作质量和效率,国家药监局发布《真实世界证据支持药物研发与审评的指导原则(试行)》。文件旨在厘清药物研发和监管决策中真实世界证据的相关定义,指导真实世界数据收集以及适用性评估,明确真实世界证据在药物监管决策中的地位和适用范围,探究真实世界证据的评价原则,为工业界和监管部门利用真实世界证据支持药物监管决策提供参考意见。
国内药讯
1.阿斯利康环硅酸锆钠散在华获批。阿斯利康新型口服降钾药物利倍卓(通用名:环硅酸锆钠散)获国家药监局(NMPA)批准上市,用于治疗成人高钾血症。环硅酸锆钠散属于第二批临床急需境外新药。此次获批,是基于全球临床试验结果和一项中国药效学研究。研究数据显示:环硅酸锆钠散服药1小时后即开始起效,达到正常血钾水平的中位时间是2.2小时,48小时内98%的患者达到正常血钾水平 。近九成患者治疗1年维持血清钾<5.1mmol/L 且在28天持续治疗期间,安全性与安慰剂无差异,治疗1年耐受性良好。
2.O药两个新适应症国内申报上市。百时美施贵宝(BMS)的PD-1单抗纳武利尤单抗(Nivolumab,商品名:欧狄沃/Opdivo,简称O药)两个新适应症的上市申请获国家药监局受理。O药是首个在国内上市的PD-1单抗,目前已获批两个适应症,分别是二线治疗非小细胞肺癌(NSCLC)及头颈部鳞状细胞癌。两个新适应症具体未披露,由于O药有多个适应症处于临床Ⅲ期,所以这两个适应症有可能是小细胞癌、胃癌、肾癌、食管癌或肝癌等。
3.健能隆医药G-CSF新药中国Ⅲ期临床结果积极。健能隆医药在研重组人粒细胞集落刺激因子-Fc融合蛋白(F-627)用于治疗肿瘤放、化疗引起的嗜中性粒细胞减少症的中国Ⅲ期临床达到预设评价标准,疗效与对照药物(原研进口药物重组人粒细胞集落刺激因子)相当。F-627的整体安全性良好,较对照药物,不良事件发生率及严重程度等方面均无明显差异,与F-627相关的不良反应多为轻中度。目前F-627也在美国、欧洲等多个国家同步开展临床研究。
4.基石启动PD-L1抑制剂联合FGFR4抑制剂的临床试验。基石药业PD-L1抑制剂CS1001与Blueprint Medicines公司FGFR4抑制剂fisogatinib联合治疗局部晚期和转移性肝细胞癌(HCC)患者的Ⅰb/Ⅱ期临床试验首例患者给药。Fisogatinib是一款高选择性成纤维细胞生长因子受体-4(FGFR4)抑制剂,在一项正在进行的评估fisogatinib单药治疗晚期HCC患者的Ⅰ期临床中已表现出临床疗效和良好的耐受性。CS1001是一款针对多个癌种的在研抗PD-L1单克隆抗体。fisogatinib联合抗PD-L1抑制剂有望在FGFR4驱动的晚期HCC患者中展现出更强的疗效。
5.恒瑞1类新药氟唑帕利获批新临床。恒瑞医药在研1类新药氟唑帕利胶囊一项新的临床申请获国家药监局批准,这款PARP抑制剂拟与醋酸阿比特龙联用,治疗既往未接受过新型雄激素受体(AR)靶向药物治疗的转移性去势抵抗性前列腺癌。该新药去年10月已递交了上市申请,审评状态现处于"在审评审批中"。药物临床登记与信息数据显示,围绕氟唑帕利胶囊开展的临床试验共计17项,适应症包括小细胞肺癌、前列腺癌、复发性卵巢癌、晚期胃癌及复发转移性三阴性乳腺癌等。
6.太极集团盐酸吗啡缓释片临床申请获受理。太极集团控股子公司西南药业盐酸吗啡缓释片(24渗透泵型)临床申请获国家药监局受理。该药主要适用于其他镇痛药无效的,需要每天、连续不断、长期阿片类镇痛治疗的疼痛。盐酸吗啡缓释片(24h渗透泵型)为含有已知活性成份的新剂型,境内外均未上市的改良型2.2类新药。一项动物药代动力学试验显示,该新药具有显著的缓释效果,能维持24h的有效血药浓度,作用时间明显长于盐酸吗啡普通片和12h盐酸吗啡缓释片,初步显现在临床应用上将有明显优势。
国际药讯
1.FDA发布2019新药年度报告。FDA药物评估和研究中心(CDER)发布2019年度报告。在2019年,CDER总计批准48款创新药,近20年来仅次于2018年的59款排在历史第二位。在48款创新药中,有20款属于“first-in-class”疗法,占总数的42%;有21款(44%)创新药批准是用于治疗罕见病或孤儿病;有29款创新药(60%)获得FDA加速审批。2019年获批的48款创新药中,84%在第一轮审评过程中获批,69%在美国首先获得监管批准。
2.门冬胰岛素Fiasp获FDA批准用于糖尿病儿童患者。FDA批准诺和诺德的Fiasp(门冬胰岛素,insulin aspart)100u/mL,作为一种新的餐时胰岛素,用于糖尿病儿童患者。一项IIIa期研究ONSET-7结果显示,在进餐时注射,与常规门冬胰岛素相比,Fiasp在总体血糖水平(HbA1c)方面取得了更好的降血糖作用(估计的治疗差异[ETD]:-0.17%)、并显著降低餐后血糖水平(餐后1小时);在进餐后20分钟注射Fiasp的患者,与进餐时注射常规门冬胰岛素的患者达到了相似的总体血糖水平(非显著性ETD:0.13%,数据有利于常规门冬胰岛素)。
3.Keytruda化疗组合治疗小细胞肺癌达临床终点。默沙东重磅PD-1抑制剂Keytruda联合化疗(依托泊苷、顺铂或卡铂)一线治疗广泛期小细胞肺癌(ES-SCLC)的Ⅲ期临床KEYNOTE-604获积极结果。与化疗相比,Keytruda联合化疗显著提高患者无进展生存期,将疾病进展或死亡风险降低25%(HR=0.75,95% CI,0.61-0.91);该组合疗法同时也提高了患者的总生存期,但数据未达到统计学意义的显著差异(HR=0.80,95% CI,0.64-0.98)。
4.默克/辉瑞PD-L1膀胱癌Ⅲ期临床结果积极。默克/辉瑞PD-L1抗体Bavencio与最佳支持护理(BSC)联用在一线维持治疗局部晚期或转移性尿路上皮癌(UC)患者的Ⅲ期临床JAVELIN Bladder 100中达主要终点。与BSC治疗组相比,Bavencio的联合疗法显著延长UC患者的总生存期。详细数据将在未来的医学会议上公布。Bavencio此前已获FDA批准用于治疗转移性默克尔细胞癌,和接受过化疗的局部晚期或转移性UC患者。
5.阿斯利康达格列净获优先审评资格。FDA受理阿斯利康SGLT2抑制剂达格列净(dapagliflozin,Farxiga)的补充新药申请(sNDA),并授予其优先审评资格,用于降低心力衰竭伴射血分数降低患者(不论有无2型糖尿病,T2D)成人心血管(CV)死亡或心力衰竭(HF)恶化的风险。sNDA的PDUFA日期定于2020年第二季度。一项Ⅲ期DAPA-HF试验结果显示,与安慰剂相比,Farxiga联合标准治疗可降低CV死亡或HF恶化复合结局的发生率。
6.默沙东达成开发KRAS小分子抑制剂的研发合作。默沙东与大鹏药品(Taiho)和大冢制药株式会社全资子公司Astex达成全球独家研究合作和许可协议。开发用于治疗癌症的KRAS靶点在内的小分子抑制剂。根据协议,默沙东将从Taiho公司和Astex公司获得其小分子抑制剂候选药物的全球独家许可,预付款为5000万美元;加上临床前、临床研究期、监管和销售方面的里程碑费用以及专利费,交易总金额有望达到25亿美元。默沙东将资助研发,并负责产品在全球的推广。Taiho保留在日本的共同商业化权利和在南亚特定地区推广的选择权。
医药热点
1.前新基中国总经理John Chin出任德琪首席商务官。德琪医药宣布任命John Chin为首席商务官(CBO),负责公司项目的全球拓展及商业布局,将直接向公司董事长及CEO梅建明博士汇报。在加入德琪前,John Chin曾任新基(Celgene)中国区总经理,领导新基中国团队,支持新基产品在中国的开发和申报上市,并推进产品与中国合作伙伴的商业化运营及销售。此前,John Chin还曾在百时美施贵宝(BMS)和默克(Merck)工作。
2.全国首例机器人辅助全脑血管造影手术成功。我国首例机器人辅助全脑血管造影手术近日在首都医科大学附属北京天坛医院成功实施。医生在监控室内通过远程遥控微创血管介入手术机器人“鲁班”精确实施了对1例陕西女患者左、右颈动脉,锁骨下动脉,椎间动脉等血管的造影手术。据悉,“鲁班”手术机器人由北京天坛医院李佑祥教授临床研究团队和北京理工大学肖楠教授的机器人技术团队联合开发,项目实施过程中实现了对同构式多器械协同管丝递送、无菌隔离非固联传动等多项微创介入手术机器人的关键技术突破。
3.宁夏首支国家紧急医学救援队通过验收。经过三年多的建设,宁夏首支国家紧急医学救援队顺利通过国家卫健委专家组验收,填补了宁夏无国家紧急医学救援队的空白。据介绍,救援队现有50名正式队员、42名后备队员,专业涵盖管理、医疗、护理专业以及医技保障、后勤保障等,并配备通信指挥、多功能急救、发电储油等车辆,以及呼吸机、监护仪、输液泵等仪器设备,可满足远程会诊、野外急救等功能需求。
股市资讯
【太极集团】公司全资子公司涪陵药厂的葛根芩连胶囊获《药品补充申请批件》,该药用于泄泻腹痛,便黄而粘,肛门灼热。
【誉衡药业】截至2020年1月6日,公司控股股东誉衡集团及一致行动人誉衡国际、健康科技的减持计划时间已过半,誉衡集团因被动减持及司法拍卖累计减持公司股份10782.87万股(公司总股本的4.91%),誉衡国际、健康科技未发生减持。
【健民集团】1)公司拟以自有资金680.00万元启动建设食品生产车间及非物质文化遗产传承基地,项目建设期为7个月。2)公司拟以自有资金投资1707.00万元对制造中心部分生产线升级改造,用于补充一条无糖型龙牡壮骨颗粒生产线,同时改造升级丸剂生产线。
审评动向
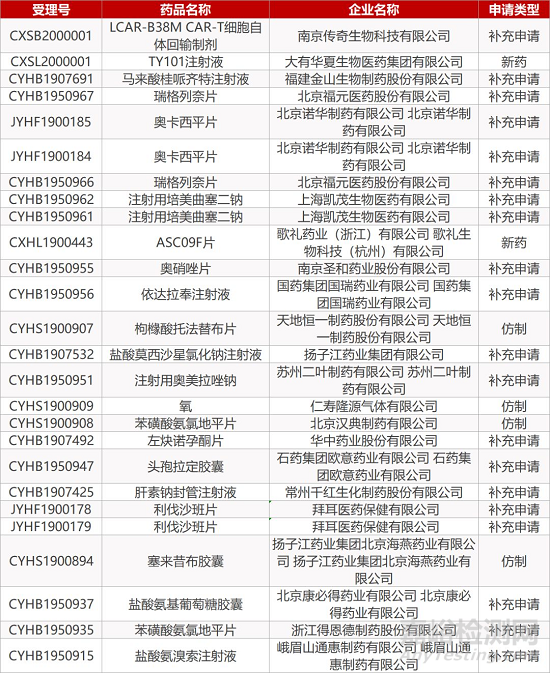
1. CDE最新受理情况(01月07日)
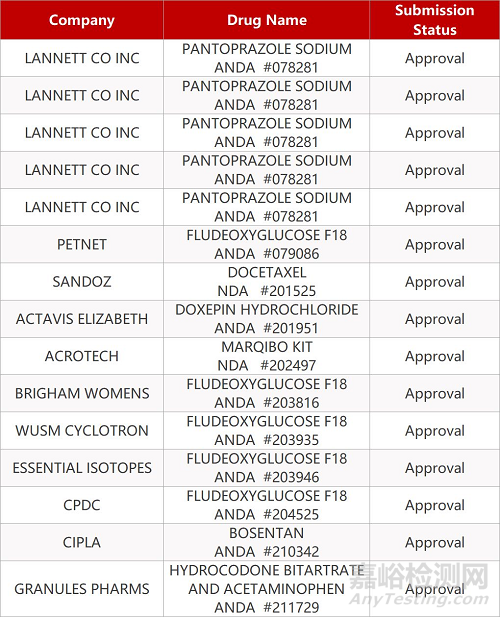
2. FDA最新获批情况(北美01月06日)

来源:药研发


