您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-03-17 09:14
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:15条资讯,阅读时长约:3分钟 」
辉瑞/默克PD-L1头颈癌III期临床提前终止。默克与辉瑞联合宣布已接受独立数据监测委员会(iDMC)的建议,提前终止抗PD-L1疗法Bavencio(avelumab)一线治疗头颈部鳞状细胞癌III期JAVELIN Head & Neck 100研究(NCT02952586)项目。该研究中期分析数据显示,与标准护理放化疗(CRT)相比,Bavencio联合CRT治疗以及随后Bavencio维持治疗的方案不太可能达到使无进展生存期取得统计学上显著改善的主要终点。目前,默克和辉瑞正在对这项研究进行详细分析,研究结果将与科学界分享。
1.注射用西维来司他钠获批上市。上海汇伦江苏药业按照3类仿制药重新提交申报的注射用西维来司他钠上市申请获国家药监局批准。西维来司钠是一种弹性蛋白酶(NE)竞争性抑制剂,由小野制药开发,于2002年4月在日本获批用于治疗伴有全身炎性反应综合征 (SIRS )的急性肺损伤/呼吸窘迫综合征。该药也是全球获批上市的唯一一款急性肺损伤治疗药物。目前,在国家新冠肺炎药品医疗器械应急平台,注射用西维来司他钠已获批临床。
2.默沙东两款HIV药物有望加速在华上市。默沙东提交的两款艾滋病毒(HIV)感染治疗药物的上市申请被国家药监局纳入拟优先审评公示名单。其中一款为非核苷逆转录酶抑制剂多拉韦林片(doravirine),另一款为doravirine与其他抗病毒药物的复方制剂——多拉韦林拉米夫定替诺福韦片。多拉韦林片(doravirine)是默沙东开发的一种每日一次的口服创新非核苷逆转录酶抑制剂,可作为单片制剂与其它抗病毒疗法灵活组合,用于治疗HIV-1感染,或者与拉米夫定(lamivudine, 3TC)和替诺福韦(tenofovir,TDF)组合形成固定剂量复方制剂。
3.复星医药益基利仑赛注射液获优先审评。复星集团引进品种益基利仑赛注射液(FKC876)获国家药监局纳入优先审评程序。FKC876是根据Kite Pharma(吉利德控股子公司)的抗人CD19 CAR-T细胞注射液(YESCARTA®)经技术转移而本地化生产,主要用于复发难治性成人大B细胞淋巴瘤(包括弥漫性大B细胞淋巴瘤(DLBCL)非特指型、原发性纵隔B细胞淋巴瘤(PMBCL)、高级别B细胞淋巴瘤和滤泡淋巴瘤转化的DLBCL)的治疗。复星凯特拥有其在中国大陆、香港和澳门区域的技术及商业化权利。
4.德琪医药ATG-008肺癌II期临床启动。德琪医药启动一项评估ATG-008治疗NFE2L2突变的晚期非小细胞肺癌(NSCLC)患者的II期临床(GTONG1702)试验,该研究主要研究者为广东省人民医院吴一龙教授。ATG-008是新一代mTOR激酶双靶点抑制剂,通过控制mTOR与其他蛋白质的结合来调节细胞的生长代谢,从而诱导肿瘤细胞凋亡并抑制肿瘤细胞增殖。该新药目前处于Ⅱ期临床开发阶段,其针对晚期肝癌的Ⅱ期临床正在中国大陆、台湾、韩国多地进行。
5.恒瑞1类新药SHR2150注射液获批临床。恒瑞1类新药SHR2150注射液获国家药监局临床试验默示许可,拟用于晚期/转移性恶性肿瘤。SHR2150是一种Toll样受体7(TLR-7)抑制剂。目前国外已有以肿瘤为适应证的同类产品处于临床试验阶段。国内该靶点在研品种较少,其中肿瘤适应症的在研品种只有正大天晴的TQ-A3334片,目前正在开展晚期非小细胞肺癌的Ⅰ期临床。此前,恒瑞的SHR2150胶囊剂型已于2018年12月1日获批临床,目前尚未看到启动临床的公开信息。
6.复星医药获COVID-19疫苗在研产品独家许可。复星医药旗下复星医药产业与一家生物技术公司BioNTech签订了一项许可协议,后者将授权复星医药产业在大中华区独家开发、商业化基于其专有的 mRNA 技术平台研发的、针对COVID-19的临床前疫苗产品。复星医药产业将向BioNTech支付至多 8500 万美元的许可费,其中包括首付款、临床开发注册及销售里程碑款项,以及约定期间35%的销售提成。BioNTech 将负责提供区域内临床试验申请所需的技术材料和临床前研究数据、配合区域内临床试验,并供应临床试验及市场销售所需的产品。
1.FDA连续颁发产品紧急使用授权。3月13日,Thermo Fisher公司的TaqPath COVID-19组合试剂盒获FDA颁发紧急使用授权(EUA),成为新冠肺炎疫情爆发后FDA授EUA的第2个商品化诊断试剂。在新冠病毒公共卫生紧急状态下,FDA对相关的诊断试剂开展全天候审评和授权,已有80余家诊断试剂开发机构寻求FDA的协助,使得开发和验证计划能够通过EUA流程进行的测试。截止北京时间3月15日零时,FDA颁布共计5项EUA,其中4项为检测试剂,1项为个人防护装备。
2.花生过敏首款免疫疗法长期试验结果积极。Aimmune 公司花生过敏疗法Palforzia在长期扩展试验ARC004中获积极结果。在Ⅲ期临床PALISADE结束后能够耐受300 mg剂量花生蛋白的患者继续接受剂量为300 mg/day的Palforzia的治疗,疗程分别为28周和56周。结果表明,56周治疗组有80.8%的患者能够耐受2000 mg花生蛋白(相当于12粒花生),28周治疗组的这一数值为49%;患者经历的副作用的次数也分别降低了59%(28周)和85%(56周);临床中患者的生活质量指数获得显著改善。Palforzia是FDA批准的首款食物过敏疗法。
3.吉利德HIV长效疗法GS-6207早期临床结果积极。吉利德在CRIO 2020会议上公布其首创HIV-1衣壳功能抑制剂GS-6207的最新临床和临床前研究数据。皮下制剂Ib期概念验证研究结果显示,与安慰剂组相比,接受GS-6207治疗的20-450mg队列的所有患者在第10天时HIV-1 RNA显著减少(p<0.0001)。HIV-1 RNA在第10天的最大减少量为0.8-3.0log10拷贝/mL。预测HIV-1 RNA的最大减少量(Emax)为2.2log10拷贝/mL。GS-6207通常安全且耐受性良好。此外,口服片剂I期研究显示,GS-6207安全且耐受性良好,单次口服剂量可达1800毫克, 该结果支持每周服用一次。
4.礼来与AbCellera公司合作开发COVID-19抗体药物。礼来与致力于开发下一代治疗性抗体的AbCellera Biologics公司拟利用新冠肺炎康复者血液共同开发抗体药物。根据协议,AbCellera和礼来将平等分担产品的初始开发成本,之后礼来将负责所有进一步的开发、制造和分销。目前,AbCellera针对COVID-19康复美国患者血液样本已鉴定出500多个独特的全人抗体序列,下一步将找出中和SARS-CoV-2最有效的抗体,并与美国国立卫生研究院(NIAID)下属的国家变态反应和传染病研究所(NIAID)疫苗研究中心(VRC)合作,测试这些抗体中和新型冠状病毒SARS-CoV-2的能力。
5.Nurix Therapeutics完成新一轮融资。Nurix Therapeutics公司宣布完成1.2亿美元融资。Nurix具有功能互补的两个专有的泛素/E3泛素连接酶平台,可将DNA编码文库(DEL)的使用和E3连接酶的扩展集结合起来,开发创新蛋白降解药物。其主要候选药物是一款拟用于治疗B细胞恶性肿瘤的口服BTK嵌合靶向分子(CTM)药物,该公司计划年底前向FDA提交该药物的IND申请。本轮融资还将用于推进其第二款药物CBL-B连接酶抑制剂至临床开发阶段,该药是一种新型的免疫肿瘤药物。
1.德国新冠肺炎确诊病例逼近5000例。德国疾控机构罗伯特·科赫研究所公布的最新数据显示,截至15日15时,德国累计新冠肺炎确诊病例升至4838例,较前一日增加1043例,死亡病例升至12例。德国政府当天宣布,将从16日上午8时起加强对奥地利、瑞士、法国、卢森堡和丹麦五国的边境管控。如无合理原因,将不再允许旅行进出。但货运交通和跨境工作通勤不受边控影响。
2.妨害传染病防治罪最高可判7年。北京警方近日通报了一起意大利输入病例在登机前吃药退烧,并隐瞒发热症状未如实申报,涉嫌妨害传染病防治罪的案例。据北京市疫情防控律师团专家介绍,根据刑法的相关规定,构成妨害传染病防治罪,将会判处三年以下有期徒刑或者拘役;对于后果特别严重的,最高可判刑7年。今年2月10日发布的《依法惩治妨害新冠肺炎疫情防控违法犯罪的意见》明确,确诊和疑似病人的妨害疫情防控行为属于抗拒疫情防控措施的犯罪行为,将按照“以危险方法危害公共安全罪”定罪处罚。
3.境外进京人员需集中隔离14天。为有效防范境外疫情的输入和扩散,北京市全面实施集中隔离措施,最大限度控制传染源、切断传播途径。从3月16日零时起,所有境外进京人员,均应转送至集中观察点进行14天的隔离观察,集中观察点将配置专业医护和工作人员,定期开展健康监测,发现问题及时处理。集中隔离观察期间,隔离人员费用需要自理。虚报信息,隐瞒病情,造成疫情传播的人员将依法依规追究责任,并纳入信用体系。
【上海医药】公司全资子公司上药信谊的“盐酸二甲双胍片(0.5g)”获《药品补充申请批件》,该药品通过仿制药一致性评价,批件号:2020B02515。
【泰格医药】公司拟发行境外上市外资股(H股)并申请在香港联交所主板挂牌上市,为完成本次发行上市,公司将转为境外募集股份有限公司。
【太龙药业】截至2020年3月16日,公司累计收到2020年失业保险应急稳岗返还补贴460.56万元。
审评动向
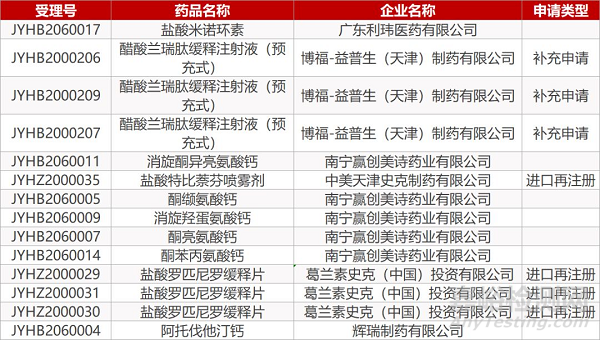
1. CDE最新受理情况(3月16日)
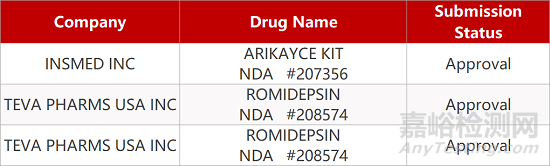
2. FDA最新获批情况(北美3月13日)
- The End -

来源:药研发


