您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-09-17 10:04
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:15条资讯,阅读时长约:3分钟 」
今日头条
国内药讯
1.恒瑞缬沙坦氨氯地平片(I)第3家获批上市。恒瑞4类仿制药缬沙坦氨氯地平片(I)获国家药监局批准上市,成为国内继百奥药业、花园药业之后第3家该品种获批厂家。缬沙坦氨氯地平片适用于缬沙坦或者氨氯地平单药治疗未能充分控制血压的患者。原研产品由诺华研发,商品名为Exforge(倍博特),其2019年全球销售额约10亿美元。缬沙坦氨氯地平片是国家医保乙类品种之一,国内市场规模大约为10亿元。
2.君实PD-1启动一项III期临床。君实生物特瑞普利单抗(拓益)登记启动一项III期临床,联合标准化疗一线治疗局部晚期或转移性尿路上皮癌。2020年5月,拓益用于治疗既往接受过系统治疗的局部进展或转移性尿路上皮癌的新适应症上市申请已获国家药监局受理。拓益是我国首个获批上市的国产PD-1药物,首个适应症为黑色素瘤。据Insight数据库显示,该药物在国内正在进行的临床试验达31项。
3.豪森阿美替尼新适应症III期临床启动。豪森三代 EGFR-TKI 创新药「甲磺酸阿美替尼片」登记启动一项III期临床,联合化疗用于非小细胞肺癌(NSCLC)围手术期治疗。该项研究旨在比较阿美替尼联合化疗或安慰剂联合化疗作为可完全切除的 EGFR 敏感突变的 II-IIIB(选择性 IIIA/B)期 NSCLC 围手术期治疗的无事件生存期。主要研究者是广东省人民医院的吴一龙教授,国内计划入组350例患者。
4.云顶新耀抗感染联合疗法Ⅰ期试验结果积极。云顶新耀ß-内酰胺酶抑制剂taniborbactam联合头孢吡肟治疗多重耐药菌(MDR)感染的中国Ⅰ期临床达主要终点,结果显示这一联合治疗方案在健康的中国志愿者中安全性与耐受性良好,其关键药代动力学参数未发现种族差异。目前,云顶新耀正在全球开展taniborbactam(VNRX-5133)联合头孢吡肟用于治疗复杂性尿路感染的关键性Ⅲ期临床试验。
5.安进/百济的CD3/Muc17双抗在华获批临床。安进/百济神州1类新药AMG 199在中国获批临床,拟用于治疗MUC17阳性的胃癌或胃食管交界部 (G/GEJ) 癌。AMG 199是一款CD3/Muc17双特异性抗体,能够使CD3阳性T细胞与MUC17阳性G/GEJ癌细胞结合,促使T细胞与肿瘤细胞交联,并诱导T细胞活化和增殖。该双抗目前处于I期临床开发阶段, FDA已于2020年6月授予其孤儿药资格认定。
国际药讯
1.诺华Beovu治疗糖尿病黄斑水肿III期临床成功。诺华宣布其新一代抗VEGF眼科药物Beovu (brolucizumab)在治疗糖尿病黄斑水肿(DME)的III期KITE研究中到达主要终点和关键次要终点。结果显示,Beovu治疗组第一年(第52周)最佳矫正视力变化(BCVA)非劣效于阿柏西普治疗组;在第40周至第52周,Beovu治疗组在中央视网膜厚度(CST)减小方面优于阿柏西普治疗组;而且两组眼内炎症发生率相当。目前Beovu针对DME的第2项临床研究KESTREL正在进行中,预计今年年底获得最终结果。
2.吉利德抗CD47单抗获FDA突破性疗法认定。FDA授予吉利德“first-in-class”抗CD47单抗magrolimab突破性疗法认定,用于新确诊的骨髓增生异常综合征(MDS)。Magrolimab是吉利德通过收购Forty Seven公司收获的一款CD47单抗。它此前已获FDA授予快速通道资格,用于治疗MDS、急性髓系白血病、弥漫大B细胞淋巴瘤和滤泡性淋巴瘤。在一项Ⅰb期临床研究中,magrolimab联合阿扎胞苷达到91%的客观缓解率,42%的患者达到了完全缓解。
3.辉瑞/BioNTech新冠疫苗志愿者出现副作用。辉瑞和BioNTech公司联合开发的新冠mRNA疫苗BNT162b2在关键性Ⅲ期临床中志愿者出现了轻微到中度的副作用。副作用包括疲劳、头痛、发冷和肌肉疼痛,有部分志愿者还出现了包括高烧在内的发烧症状。由于试验处于双盲阶段,出现副作用的志愿者尚不清楚来自于疫苗组还是安慰剂组。目前,已有2.9万人参加了试验,超过1.2万名志愿者已接种了第二剂疫苗。
4.Mallinckrodt肾功能衰竭药物遭FDA拒绝批准。FDA拒绝了Mallinckrodt特利加压素(Terlipressin)用于治疗罕见的进行性肾功能衰竭的申请。特利加压素是一种针对V1受体具有选择性的血管加压素类似物,已在治疗1型肝肾综合征(HRS-1)的Ⅲ期临床中达主要终点指标,并赢得了咨询委员会的支持。在完整回应函中,FDA对在Ⅲ期临床中使用的替代终点是否转化为有意义的临床益处(可抵消包括败血症在内的风险)存有疑问,FDA认为还需要更多信息来支持特利加压素在HRS-1患者中的获益大于风险。
5.NiKang Therapeutics完成B轮融资。致力于创新性小分子抗肿瘤药物开发的NiKang公司宣布完成5000万美元B轮融资。本轮融资由RTW Investments领投,同时还获得礼来亚洲基金等新投资者的额外支持。所得款项将用来支持一些有前途的肿瘤学药物已计划的临床前和临床开发,并进一步改善该公司的药物开发渠道。今年4月,翰森制药已与NiKang Therapeutics就一款临床前小分子抗病毒药物NKT-1992在大中华区的开发和商业化达成合作关系。
6.BMS行使选择权获得一款在研CD40L细胞疗法。Obsidian Therapeutics宣布,百时美施贵宝行使了一项全球独家许可选择权,获得其CD40L细胞疗法候选药物。CD40L是一种肿瘤坏死因子超家族成员,在活化的CD4 T细胞上瞬时表达,通过与CD40受体的相互作用促进树突状细胞(DC)的许可和激活。即使天然CD40L下调,在CAR-T细胞中共表达工程化CD40L有可能减少抗原阴性肿瘤的逃逸,从而提高抗肿瘤的疗效。根据协议,Obsidian有资格获得该候选药物潜在的未来里程碑和版税付款。
医药热点
1.兰州兽研所布病复核阳性3245人。兰州卫健委发布兰州兽研所布鲁氏菌抗体阳性事件的情况通报,截至2020年9月14日,累计检测21847人,初步筛出阳性4646人,省疾控中心复核确认阳性3245人。兰州生物药厂将根据相关法律法规、标准,于10月份分批次开展补偿赔偿工作。目前,针对该事件,国家药监局已撤销了兰州生物药厂布病疫苗生产许可、布鲁氏菌病活疫苗(S2株)和布鲁氏菌病活疫苗(A19株)产品批准文号,同时注销了该生产车间生产的疫苗产品共7个兽药产品批准文号。相关的8名责任人也已被依法处罚。
2.全国耗材带量采购启动。国家医保局会同有关部门在天津召开了国家组织高值医用耗材集中采购和使用工作启动会。冠脉支架将是首批国采品种。按照天津医保局副局长张铁军公布的时间表,9月份将组织各联盟医疗机构完成历史使用量和未来需求量的上报统计工作;10月份,集采文件将面向全社会公布;11月份,结合企业申报的价格确定最终中选结果;到2021年1月1日,中选结果将全面进入实施阶段。
3.上海市医疗行业专项整治即将启动。上海市卫健委发布两份医药纠风通知,《上海市2020年纠正医药购销领域和医疗服务中不正之风工作要点》明确将打击商业贿赂等违法行为,严肃查处收取医药耗材企业回扣行为;《上海市2020年医疗行业作风建设工作专项行动实施方案》提出严惩收受红包、收取提成、统方等违规行为。专项整治时间分3个阶段实施:教育与自查阶段(2020年9月);集中宣传与整治阶段(2020年10月至11月);评估与总结阶段(2020年12月)
股市资讯
【康泰生物】(1)子公司民海生物的吸附无细胞百白破灭活脊髓灰质炎联合疫苗和五联疫苗临床试验申请获得国家药监局的受理,前者为后者基础,产品用于预防白喉、破伤风、百日咳、脊髓灰质炎和b型流感嗜血杆菌引起的侵入性感染,目前国内市场仅有进口产品。(2)公司刘建凯、李彤通过大宗交易的方式,以176.26元/股价格出售合计42.1万股,占公司总股本0.06%。
【华东医药】公司全资子公司中美华东通过出资现金5000万元及销售分成的方式,收购蓬莱诺康拥有的腺苷注射液和腺苷注射液(供诊断用);产品可用于冠心病诊断。因蓬莱诺康为公司控股股东远大集团的下属企业,中美华东为本公司全资子公司本次交易构成关联交易。
【华东医药】微境生物将其研发的四款药物WJ1024/WJ1075(可用于多种血液瘤和实体瘤)、WJ05129(用于治疗小细胞肺癌和三阴乳腺癌等RB1缺失或失活的恶性肿瘤)、APL1898(一种有效抑制EGFR-exon20插入变异的靶向小分子抑制剂)、WJ13404(一种有效的第四代EGFR抑制剂)的50%权益转让给公司,公司将向微境生物支付3,600万元,不超过4.36亿元人民币的里程碑付款,50%的销售提成。
审评动向
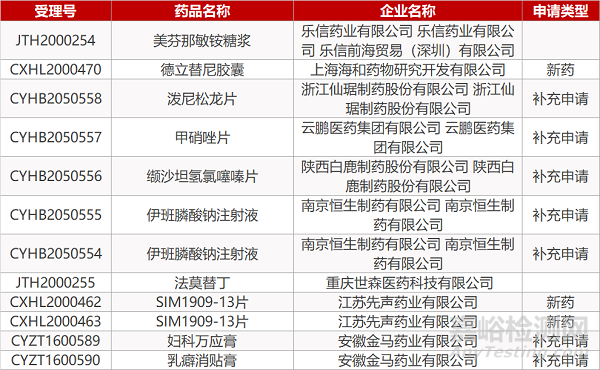
1. CDE最新受理情况(09月16日)
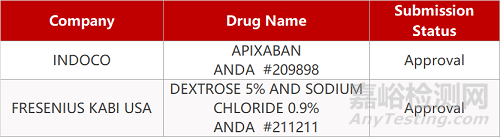
2. FDA最新获批情况(北美09月14日)
- The End -

来源:药研发


