您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-01-07 09:16
国家药监局关于调整《医疗器械分类目录》部分内容的公告(2020年第147号)于元旦前夕发布,成了器械圈节日里最关注的话题。触动着每位注册人的神经,因为不论在中国还是美国、欧盟地区,不同的产品的分类对应不同的合规路径。
先介绍一下近日的发布稿,与国家药监局综合司公开征求《医疗器械分类目录》内容调整意见(2020-03-20)中发布的征求意见稿的区别。
《医疗器械分类目录产品管理类别调整意见汇总表》,共15类医疗器械管理类别进行调整(征求意见稿中共16类,其中删除2类,新增1类)。
新增:

删除:
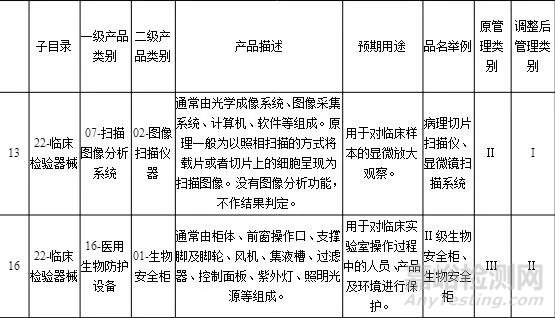
《医疗器械分类目录内容调整意见汇总表》,共13类医疗器械目录内容进行调整(征求意见稿中共15类,无新增,删除2类)。
删除:
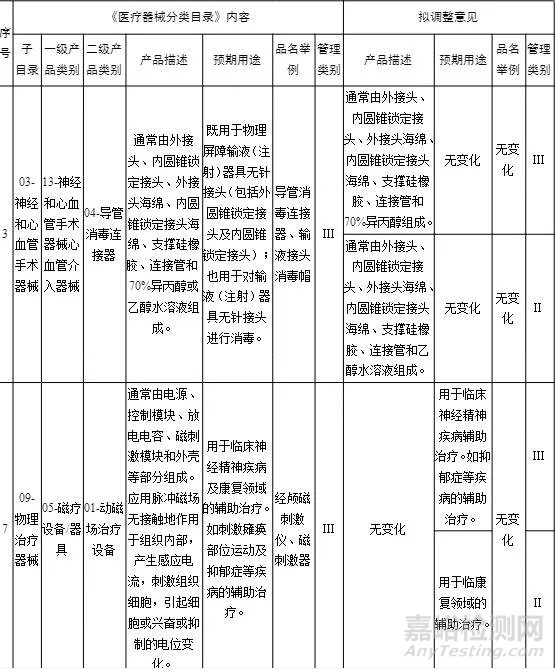
作为监管部门也非常希望广大企业积极参与其中,国家药监局综合司2020年11月12日发布了《医疗器械分类目录动态调整工作程序(征求意见稿)》规范《医疗器械分类目录》动态调整工作,当中第四条提到了【调整建议提出的方式】境内器械相关企业可以向省(市、区)药品监督管理部门提出《分类目录》调整建议。
医疗器械分类目录调整后,关于产品注册申报的建议:
1. 首次注册申报
涉及分类调整的医疗器械产品,自公告发布日起,计划申报但申报申请还未受理的,可以按照调整后的管理类别进行注册或备案申请,例如电子内窥镜由Ⅲ类降为Ⅱ类,由国家药监局受理审评审批变为由注册人所在的省药监局进行受理审评审批,可以向省局申请第二类医疗器械产品首次注册。眼球突出计由Ⅱ类降为I类,可以向市局申请第一类医疗器械产品备案。
对于已受理尚未完整注册审评(包括首次注册和延续注册)的医疗器械,仍按照原来的管理类别进行审评审批,到时候产品注册证备注栏会注明调整后产品的管理类别。
2. 延续注册申报
对于已注册的医疗器械产品,管理类别有调整的,原来的注册证在效期内继续有效。若由Ⅲ类降为Ⅱ类,在注册证有效期届满6个月前,按照改变后的管理类别向相应的监督管理部分申请延续注册,例如电子内窥镜,在证到期前6个月向注册人所在的省局提交第二类医疗器械产品延续的申请。准予延续注册后,会按照调整后的管理类别核发医疗器械注册证。
若由Ⅱ类降为I类的已注册医疗器械,注册证到期前,注册人向所在的市局监管部门申请产品备案,备案资料符合要求的,核发备案证。例如眼球突出计,现在的注册证到期前向所在的市局监管部门申请产品备案获得产品备案证即可,无需再办理产品注册证延续。
3. 变更注册申报
与延续注册不同,医疗器械注册证有效期内发生注册变更的,仍然向原来的注册部门申请变更。例如电子内窥镜,若需要变更,按照法规的要求,还是需要向国家局申请第三类医疗器械变更;同样眼球突出计需要变更,也是按照相应法规要求向当地省局申请第二类医疗器械变更。
当存在变更需求时,请根据实际情况综合考虑是否可以先进行注册延续或申报产品备案,再来考虑变更。在这种情况下,例如电子内窥镜可以按照管理类别调整后向注册人所在省局申报延续,获得产品的第二类医疗器械注册证后,那就可以向省局申请第二类医疗器械变更;眼球突出计可以按照管理类别调整后向所在地市局监管部门申请产品备案,当获得产品备案证后,再申请备案变更。
4. 医疗器械生产和经营
对于首次申报的产品,直接按照调整后的管理类被申请产品注册或产品备案,获得注册或备案证后,申请相应的生产许可或生产备案。对于延续的产品,由Ⅲ类降为Ⅱ类,向省局监管部门申请生产许可变更。由Ⅱ类降为I类的已注册医疗器械,获得备案证后,一般是向所在的地的区局或市局申报生产备案,已办理过生产备案的企业,可以申请生产备案变更。
医疗器械经营企业(非生产企业)按照所经营产品的注册证或备案证信息,由Ⅲ类降为Ⅱ类,未办理过第二类医疗器械备案证的企业,向相应的监管部门申请经营备案,原来已办理过第二类医疗器械经营备案证的企业,根据产品的分类,进行经营备案变更,由Ⅱ类降为I类,经营一类产品不需要进行许可和备案。
此次调整《医疗器械分类目录》部分内容总结如下:
内窥镜手术用有源设备、泌尿X射线机、口腔X射线机、光学内窥镜、电子内窥镜、内窥镜辅助用品、妇产科诊断器械管理类别由三类调整为二类。
牙科光学喷粉器、种植体定位器、红细胞沉降仪器、微生物比浊仪器、医用显微镜原属于二类有源医疗器械产品管理类别调整为一类。二类无源器械计数板、血液采集卡、眼球突出计调整为一类管理。
雾化面罩、输氧面罩、义眼片、牙科骨膜、三棱针、皮肤针、滚针共7个产品《医疗器械分类目录》进行内容调整,原来全部为二类,调整后产品预期用途不变,产品描述中无菌提供的产品,还是按照二类管理,若非无菌提供按照一类产品管理。
《医疗器械分类目录》内容发生了相应调整的产品还有氩保护气凝设备、电动吻合器、透视摄影X射线机、眼科超声诊断设备、口腔植入及组织重建材料、排龈材料。

来源:CIRS医疗器械监管动态


