您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-05-07 09:24
在当今的全球化时代,要满足各个国家和地区药政监管机构在招募多样化受试人群方面的期望是有挑战性的。对更快的药物研发和更短的临床试验招募时间的迫切需求,使得药物开发的这一重要部分变得更加困难。
在我们的工作中经常有新药研发公司问到这样一些问题:“我们的临床试验需要在美国招募多少受试者?”, “我们在中国(或其他国家)的临床数据能够被FDA接受吗?”, “NDA/BLA 要包含多少美国受试者的数据才能满足FDA的审批要求?” 。
这些问题没有统一的答案,因为每一个在研的新药及其治疗的适应症并不完全相同。
在过去的几十年里,FDA一直在努力使临床试验能更精确地代表新药获批后最有可能使用该药物的实际患者人群,而达到这一目标的主要手段是通过拓宽临床试验入组资格标准以解决特定病人群体在临床试验中代表不足的问题。
这些年里, FDA发布了一些相关的指导原则。 为了符合2017年《FDA重新授权法案》(FDARA), FDA在2020年11月发布了《加强临床试验人群的多样性-资格标准、入组实践和试验设计》的指导原则,讨论了对研究人群的人口统计学特征(例如,性别、种族、年龄)和非人口统计学特征(例如,器官功能障碍、合并症、残疾)的考虑和建议。
在本系列“专家解读”里, 我们将从种族、年龄、 性别和跨国临床研究数据的可接受性等几个方面专题介绍和分析临床试验招募病人的多样化与FDA的相关法规要求。
在FDA药品评价与研究中心(Center for Drug Evaluation and Research, CDER)于2020年底发布的药物临床试验快报(Drug Trials Snapshots, DTS)5年总结报告中,CDER汇总并分析了2015-2019年期间的231个DTS(包括所有获得FDA批准的创新型小分子药物与原创型生物制品)临床试验受试者人口统计数据。我们在这期“专家解读”里概要介绍有关统计数据。
01 临床试验受试者国家分布-三分之二来自美国之外
支持2015年至2019年美国FDA药品批准的临床试验受试者中,有近三分之二来自美国以外的世界其他地区。在参与分析的292,766名受试者中,数量列美国之后的三个国家是波兰、德国和俄罗斯,分别占总数的4%,其次是日本、加拿大和捷克共和国,约占3%,中国约占1%。
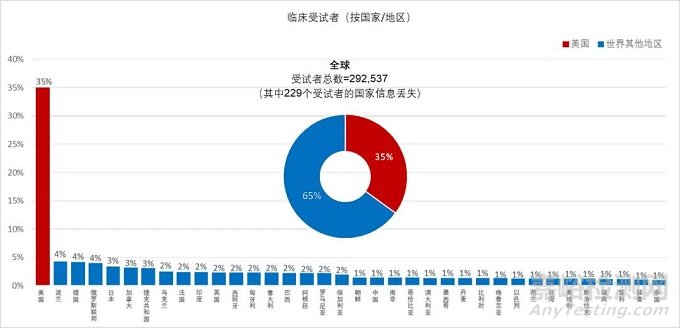
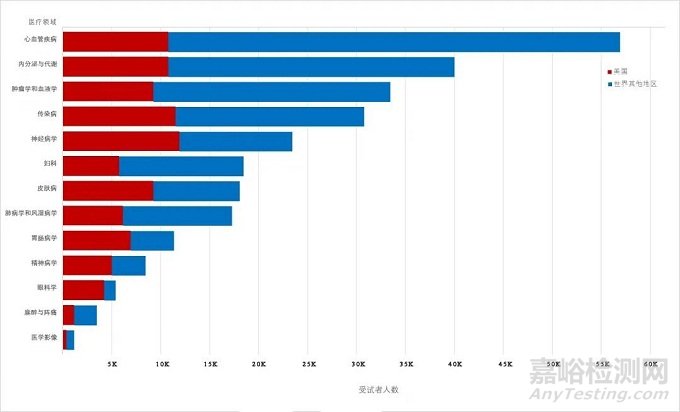
药物临床试验包含的数据大多同时来自美国和国外的研究基地;仅有10.3%的新药申请只包括来自美国受试者数据,5.4%的新药申请只包括来自国外的受试者数据。
在美国各州中,加利福尼亚州、佛罗里达州和德克萨斯州的受试者人数最多,分别为14,525、12,038和8,709。
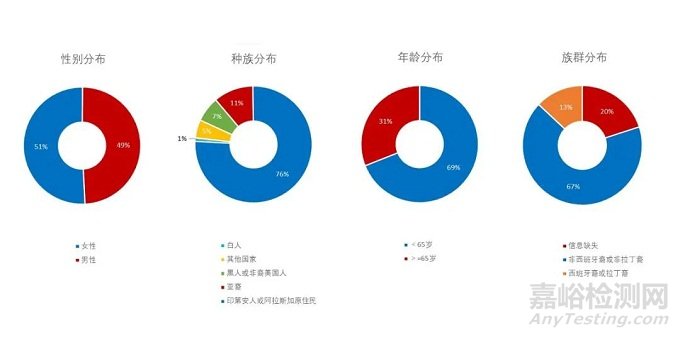
02 临床试验受试者按性别、种族、年龄和族群分布
下面四个图概括描述了支持2015年至2019年美国FDA药品批准的临床试验中受试者的性别、种族、年龄和族群分布。我们将在后面的“专家解读”里具体介绍。
信息来源:
[1] 2015-2019 Drug Trials Snapshots Summary Report. US Food and Drug Administration, November 2020.
[2] FDA Guidance for Industry: Enhancing the Diversity of Clinical Trial Populations -Eligibility Criteria, Enrollment Practices, and Trial Designs. November 2020.
[3]奥来恩专家解读:FDA加快创新药研发与审评的通道-2020年CDER批准的新药分析. 2021-02-05. https://mp.weixin.qq.com/s/uJRZz12QwAmvdWEaz6Oq5g.
[4] 奥来恩专家解读:FDA孤儿药认定-新药研发与审评的加速通道系列之五. 2021-04-16. https://mp.weixin.qq.com/s/4OAmFQ6TSNsdsq8On7swgg.

来源:Internet


