您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-05-31 13:30
本文适用于第二类观察用硬性光学内窥镜产品,即喉镜、鼻窦镜、尿道膀胱镜、宫腔镜、直肠镜。其他第二类硬性光学内窥镜也可参考本文适用的内容。
第二类硬性光学内窥镜产品是利用人体自然腔道进入人体观察和诊察,不需切口或打孔穿刺进入人体。
硬性光学内窥镜产品的结构和组成
硬性光学内窥镜主要由光学成像系统和照明系统组成
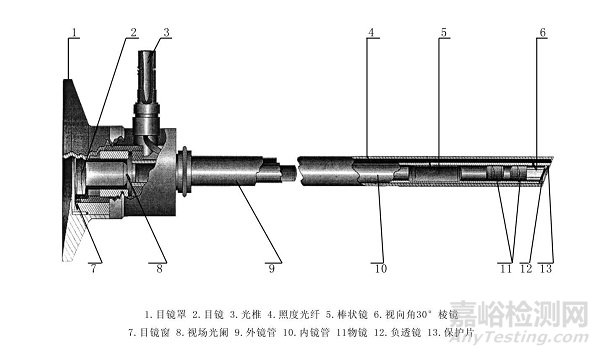
硬性光学内窥镜产品的研发试验要求
1.产品性能研究
开发者应当开展产品性能研究,确认产品技术要求,包括功能性、安全性指标。并对质量控制相关的其他指标进行确认,对所采用的标准或方法、采用的原因及理论基础进行验证。
2.生物相容性评价研究
开发者应对产品中与患者和使用者直接或间接接触的材料的生物相容性进行测试评估。明确生物相容性评价的依据和方法,对产品所用材料进行描述并确认人体接触的性质,如实施或豁免生物学试验,需要给出理由并进行论证,需对已有数据或试验结果进行评价。具体生物学评价要求参照《关于印发医疗器械生物学评价和审查指南的通知》(国食药监械﹝2007﹞345号)。
3.生物安全性研究
内窥镜产品不含有同种异体材料、动物源性材料或生物活性物质,本条不适用。
4.灭菌/消毒工艺研究
开发者应当明确消毒或灭菌工艺。如灭菌使用的方法容易出现残留,应当明确残留物信息及采取的处理方法。
5.产品有效期和包装研究
开发者应对产品有效期或使用次数进行研究。对于产品的包装及包装完整性的要求应符合GB/T 14710-2009 《医用电气设备环境要求及试验方法》标准要求。
6.床前动物试验
不适用。
7.软件研究
本内窥镜为不含有软件的产品,本条不适用。
8.其他研究
开发者可以开展证明产品安全性、有效性的其他研究。
硬性光学内窥镜产品性能指标
1.光学性能
(1)视场角和视向角:
视场角:内窥镜视场角的设计值与名义值的偏差最低要求为不大于15%,且应符合专用标准(如有)的要求。
视向角:在光学镜上应标注视向角的名义值,允差:θ≤30°时,允差:±3°;30<θ≤100时,允差:±10%;θ>100°时,允差:±10°,且应符合专用标准(如有)的要求。
(2)像质
角分辨力:内窥镜视场中心角分辨力的标称值为××C/(°),允差-10%(上限不计),对应的设计工作距为d0。以相同光学工作距处的垂直视轴的平面作视场,在最大视场高度的70%位置上任选四个正交方位测量,平均角分辨力不低于实测的视场中心角分辨力的90%。
(3)有效景深范围
在内窥镜有效景深范围内,视场中心的角分辨力应不低于设计光学工作距处角分辨力测量值的80%。试验应至少包括有效景深范围的最远端。
(4)视场质量
视场应无重影或鬼影、闪烁等效应,无可见杂质、气泡等缺陷。
(5)颜色分辨能力和色还原性
内窥镜有良好的颜色分辨能力和色还原性。当采用ISO 10526:1999CIE S005 规定的A和D65标准照明体的光谱,经照明光路和成像系统传输后输出,其输出光谱仍能保持良好的显色性。在A标准照明体下的显色指数Ra的名义值为××,在D65标准照明体下的显色指数Ra的名义值为××,实测值不小于名义值。
(6)照明变化率
内窥镜经灭菌消毒试验后,其照明光路的光能积分透过率应保持稳定,用输出光通量衡量,光通量变化率应不大于20%。
(7)照明有效性
边缘均匀性
边缘均匀度要求
|
标称视向角范围 |
均匀度 |
|
θ≤30° |
≤25% |
|
30°<θ≤50° |
≤35% |
|
50°<θ |
≤45% |
照明镜体光效:内窥镜在WP的90%视场处的照明镜体光效ILeR的名义值为××,照明镜体光效ILeR的测定值应不小于名义值。
(8)综合光效
内窥镜在WP的90%视场处的综合镜体光效SLeR的名义值为××,测定值应不小于名义值。
综合边缘光效(SLe-Z)的名义值为××,测定值不小于名义值。
(9)光能传递效率——有效光度率
内窥镜有效光度率的名义值为××,实测值应不大于名义值。
(10)单位相对畸变
内窥镜在设计工作视场形状下/评价视场面形状下单位相对畸变的控制量为××,畸变一致性符合下表的要求。
畸变一致性要求
|
单位相对畸变范围 |
一致性差 |
|
≤25% |
≤4%(绝对差) |
|
25%< |
≤16%(相对差) |
|
绝对差表示单位相对畸变最大值与最小值相减的结果;相对差表示单位相对畸变的绝对差与单位相对畸变均值之比的结果。 |
|
(11)照明光源和观察视场的重合性
在工作距离处照明光斑应充满视场,无明显的亮暗分界线。
2机械性能
(1)工作长度,L:内窥镜工作长度的标称值,允差:±3%。
(2)插入部分最大宽度:内窥镜插入部分最大宽度的标称值,实测值不大于标称值。
(3)器械通道最小宽度:对于含器械通道的内窥镜,该通道的最小宽度应不小于标称值
(4)目镜罩尺寸:目镜罩的尺寸和允差应符合规定。
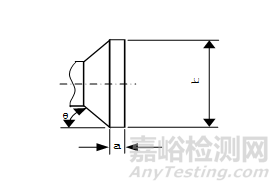
目镜罩形状简图
目镜罩尺寸和允差
|
尺寸名义值 |
允差 |
|
b=31.75mm |
下限-0.10mm,上限0 |
|
a=4.7mm |
下限0,上限+0.1mm |
|
θ=50° |
±10° |
(5)配合
锁止和插拆与镜鞘或镜桥、镜鞘配合,锁止与插拆应符合下述要求:配合后应能锁止,锁止应可靠。插入轻松自如、拆卸方便。
定位和密封与镜鞘或镜桥、镜鞘配合后应满足下述要求:锁止后应定位可靠,无松动现象;锁止后应密封良好,做渗水性试验时1分钟内渗水不得超过5滴。
(6)封装
雾层:含光学元件的内窥镜,封闭的内部应清洁干燥,经低温至高温突变试验后,内部无视场模糊现象。
封装可靠性含光学元件的内窥镜应能承受如下密封性的试验不失效:水下1m历时12h水压试验;按制造商规定的灭菌或消毒方法循环20次试验。
(7)连接
内窥镜各组件之间的连接牢固可靠,各连接部分,若采用紧配合方式连接,其配合处应无明显可见缝隙;若采用焊接方式连接,其焊缝处应无凹凸不均匀、脱焊、堆焊或明显的麻点现象;若采用胶合方式连接,其胶合处应无溢流或明显胶堆现象,其他部分无胶流纹痕。
(8)插入部分外表面质量
插入部分除特殊目的外,不应有任何可能引起的安全伤害存在。对于特殊目的的需要而存在可能引起安全伤害的插入部分,应采用所有可能方式,以使不希望的危害减至最小。所采取的方式中至少应包括在随附资料中的下述说明:警告可能出现的危害提示,危害的预防手段,以及危害发现后的处理说明;安全的操作规程;操作者需通过专门培训才能使用的声明。
(9)表面和边缘
内窥镜应当设计成对人体不会造成任何意外伤害。内窥镜的所有表面不得有细孔、裂纹和毛刺。
(10)可重复消毒或灭菌产品的耐受性
对于可重复消毒或灭菌的硬性内窥镜,消毒或灭菌方法应既不能损坏产品的功能,也不能产生腐蚀。
(11)电气安全性能要求
内窥镜与医用电气设备互连使用的安全要求应符合YY0068.4-2009中6的要求及GB 9706.1-2007、GB 9706.19-2000规定的要求。
(12)环境试验
内窥镜的环境试验要求应符合GB/T14710-2009、GB 11244-2005中气候环境试验I组、机械环境试验I组的规定,并按附录A的规定进行试验。部分内窥镜有现行行业标准的,则环境试验要求应符合内窥镜行业标准中的具体要求。
硬性光学内窥镜产品的主要风险
1.能量危害
(1) 电能:与冷光源、摄像显示系统等有源医疗器械互连使用时可能对使用者、患者产生电击危害。
(2)热能:与冷光源等有源医疗器械互连使用时可能超温,对患者产生灼伤危害。
2.生物学危害
(1)生物不相容性:如果制造硬性光学内窥镜插入部分的材料不符合生物相容性要求,就可能对患者产生细胞毒性、致敏、刺激等危害。
(2)交叉感染:如果硬性光学内窥镜在使用前后,不按规范严格地清洗、消毒和灭菌,就可能对患者产生交叉感染的危害。
3.环境危害:如果硬性光学内窥镜在没有按要求包装运输,或贮存环境不满足要求,或使用时发生摔打、跌落和碰撞,就会造成镜片损坏发霉发雾、光轴偏移、管身瘪陷、密封性能变差而引起图像不清等现象,可能对患者产生误诊等危害。
4.与消耗品、附件、其他医疗器械不兼容
硬性光学内窥镜使用时往往需要与消耗品、附件、其他医疗器械一起使用,它们之间是否相容,对安全影响很大。如硬性光学内窥镜与手术器械不兼容,造成手术器械无法顺畅插入,或无法出现在硬性光学内窥镜的视场中,导致危害发生。
5.锐边与锐尖:如果硬性光学内窥镜或配合器械插入部分表面存在非期望的尖锐边缘或突出物等疵病,有可能损伤皮肤、粘膜、血管,甚至造成大出血。
6.角分辨力、颜色分辨能力和色还原性、边缘均匀性、综合光效、有效光度率、单位相对畸变性能不良:硬性光学内窥镜的角分辨力、颜色分辨能力和色还原性差,边缘均匀性、综合光效、有效光度率性能不好,单位相对畸变增大,可能影响医生的观察和操作,造成误诊或手术失败。
7.对硬性光学内窥镜寿命期缺少适当的规定:硬性光学内窥镜有一定的寿命期,在适当的寿命期外使用硬性光学内窥镜,会使风险增加。
硬性光学内窥镜产品适用的相关标准
1.适用的国家标准、行业标准
|
标准号 |
标准名称 |
|
GB9706.1-2007 |
医用电气设备 第一部分:安全通用要求 |
|
GB 9706.19-2000 |
医用电气设备 第2部分:内窥镜设备安全专用要求 |
|
GB 11244-2005 |
医用内窥镜及附件通用要求 |
|
YY 0068.1-2008 |
医用内窥镜 硬性内窥镜第1部分:光学性能及测试方法 |
|
YY 0068.2-2008 |
医用内窥镜 硬性内窥镜第2部分:机械性能及测试方法 |
|
YY 0068.3-2008 |
医用内窥镜 硬性内窥镜第3部分:标签和随附资料 |
|
YY 0068.4-2009 |
医用内窥镜 硬性内窥镜第4部分:基本要求 |
|
YY 1075-2007 |
硬性宫腔内窥镜 |
|
YY 91083-1999 |
纤维导光膀胱镜 |
2.可引用或参照的国际标准:
|
标准号 |
标准名称 |
|
ISO8600-1-2013 |
内窥镜—医用内窥镜和内窥镜附件 第1部分:一般要求 |
|
ISO8600-3-1997 |
光学和光学仪器—医用内窥镜及内窥镜附件 第3部分:视场角和视向角的测定 |
|
ISO8600-4-2014 |
内窥镜--医用内窥镜及内镜治疗装置--第4部分: 插入部分最大宽度的测定 |
3.可引用或参照的其他相关标准:
|
标准号 |
标准名称 |
|---|---|
|
GB/T 191-2008 |
包装储运图示标志 |
|
GB/T 14710-2009 |
医用电气设备环境要求及试验方法 |
|
GB/T 16886.1 -2011 |
医疗器械生物学评价第1部分:风险管理过程中的评价与试验 |
|
GB/T 16886.5-2003 |
医疗器械生物学评价第5部分:体外细胞毒性试验 |
|
GB/T 16886.10-2005 |
医疗器械生物学评价第10部分:刺激与迟发型超敏反应试验 |
|
YY 0076-1992 |
金属制件的镀层分类、技术要求 |
|
YY/T 0149-2006 |
不锈钢医用器械 耐腐蚀性能试验方法 |
|
YY/T 0294.1-2005 |
外科器械 金属材料第1部分:不锈钢 |
|
YY 0466-2009 |
医疗器械 用于医疗器械标签、标记和提供信息的符号 |
|
YY/T 0466.1-2009 |
医疗器械 用于医疗器械标签、标记和提供信息的符号 第1部分:通用要求 |

来源:嘉峪检测网


