您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-07-09 10:43
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
1.替雷利珠单抗新适应症申请上市。CDE受理百济神州PD-1抗体百泽安(替雷利珠单抗注射液)用于治疗既往接受过一线标准化疗后进展或不可耐受的局部晚期或转移性食管鳞状细胞癌(ESCC)患者的新适应症上市申请。在一项全球Ⅲ期临床RATIONALE 302中,百泽安在意向性治疗(ITT)人群的中位总生存期达8.6个月,降低死亡风险超过30%,达主要终点指标。
2.再鼎靶向FcRn创新药获批临床。再鼎医药引进的efgartigimod注射液获国家药监局三项临床试验默示许可,拟开发治疗原发免疫性血小板减少症、天疱疮。efgartigimod是argenx公司开发的一款靶向FcRn的“first-in-class”疗法,再鼎拥有efgartigimod在大中华区的独家权益。目前,efgartigimod正在全球范围内开展多项临床研究,涉及的适应症包括重症肌无力、寻常性天疱疮、免疫性血小板减少症、慢性炎症性脱髓鞘性多发性神经病等。
3.百奥泰TIGIT单抗获批临床。百奥泰TIGIT靶向单抗药物BAT6021注射液获国家药监局临床试验默示许可,拟临床用于晚期恶性实体瘤的治疗。Insight数据库显示,当前国内共9个进入临床的TIGIT相关项目。进展最快的是百济神州,Ociperlimab与PD-1联合治疗的开发已进入Ⅲ期临床阶段;信达生物的PD-1/TIGIT双抗IBI321目前已处于Ⅱ期临床,单抗IBI939处于Ⅰ期临床;君实的JS006也已进入Ⅰ期临床。
4.恒瑞化疗辅助用药HR20013获批临床。恒瑞医药子公司盛迪医药研发的注射用HR20013获国家药监局临床试验默示许可,拟临床用于预防化疗后急性和延迟性恶心、呕吐。化疗后的恶心呕吐(CINV)是最常见的化疗不良反应之一,发生率高达60%-80% 。CINV会降低患者对治疗的依从性,在身体方面使患者代谢失衡、营养不良、体重减轻,严重影响患者的生活。目前,国内外尚未有同类产品获批上市。
5.奥布替尼将在欧洲启动II期临床。诺诚健华BTK抑制剂奥布替尼用于治疗多发性硬化(MS)的临床试验申请(CTA)在波兰和乌克兰获批,即将在这两个国家开展II期临床,评估奥布替尼用于治疗复发缓解型MS的有效性、安全性、耐受性、药代动力学和生物活性。这是一项全球多中心的II期临床,2020年11月和2021年4月,奥布替尼已分别获FDA和NMPA批准开展治疗MS的II期临床研究。
国际药讯
1.WHO推荐IL-6抑制剂治疗新冠。世卫组织更新COVID-19患者护理指南,纳入IL-6抑制剂。这是自2020年9月该组织推荐皮质类固醇以来发现的首个对COVID-19有效的药物。世卫组织发起的一项前瞻性和荟萃研究的结果显示,与标准治疗相比,在严重或危重患者中使用IL-6抑制剂(例如tocilizumab和sarilumab)可使死亡几率降低13%;将需要机械通气的几率降低28%。
2.诺华Leqvio在美重新提交NDA。诺华siRNA降胆固醇药物Leqvio(inclisiran)日前已重新向FDA提交上市申请。去年12月,因该疗法位于意大利的生产工厂尚未解决此前在审查资料时发现的生产工艺相关问题,FDA拒绝批准Leqvio上市。目前诺华正在将该药物的成品生产从意大利工厂转移到位于奥地利Schaftenau的内部工厂。在欧盟,该疗法已获批用于治疗成人高胆固醇血症及混合性血脂异常。
3.IL-12基因疗法与K药联合用药上Ⅲ期临床。OncoSec Medical公司IL-12 DNA质粒疗法TAVO(tavokinogene telseplasmid)联合默沙东PD-1疗法Keytruda即将开展一项国际Ⅲ期临床KEYNOTE-C87,评估联合用药在晚期转移性黑色素瘤患者中的安全性和有效性。该项临床预计注册400例患者。在关键性Ⅱb期临床中,这一组合已在54例可评估患者中使5例患者的肿瘤完全消失。TAVO是一款潜在“first-in-class”抗癌基因疗法,这一试验将用于支持向FDA寻求加速批准。
4.新型“人造皮肤”Ⅲ期临床结果发表。Mallinckrodt公司旗下Stratatech开发的“人造皮肤”StrataGraft在关键性Ⅲ期临床中达到两个共同主要终点。试验结果表明,接受StrataGraft单次移植治疗的深度烧伤患者,在第3个月时,烧伤部位中96%不再需要自体皮肤移植手术;83.1%的患者在没有自体移植的情况下,实现了StrataGraft治疗部位的持久伤口闭合(95% CI:74.4,91.8)。这款创新疗法已于今年6月获得FDA批准上市。
5.Moderna季节性流感mRNA疫苗启动临床。Moderna公司4价季节性流感mRNA候选疫苗mRNA-1010在Ⅰ/Ⅱ期临床中完成首批受试者接种。该项试验将在180名18岁及以上健康成人中评估mRNA-1010的安全性、反应原性和免疫原性。mRNA-1010靶向4种季节性流感病毒株(甲型流感病毒株H1N1和H3N2,和乙型流感病毒株Yamagata和Victoria)。它有望让人们在每个秋天只需接种一次,就能提供针对最有威胁的呼吸道病毒的高效保护。
6.CD3单抗上市申请遭FDA拒绝。FDA拒绝批准Provention Bio抗CD3单抗teplizumab用于延缓高危个体临床1型糖尿病(T1D)的生物制品许可申请(BLA)。FDA认为,在健康志愿者中进行的一项单剂、低剂量药代动力学/药理学(PK/PD)桥联研究中,teplizumab与之前用于临床试验产品进行比较,未能显示PK可比性。由于PK仍然是证明两种产品可比性的主要终点,FDA要求该公司适当地建立teplizumab和临床试验产品之间的PK可比性,或提供其他足以证明PK可比性没有必要的数据。
医药热点
1.北京增加家庭医生签约服务供给。北京市卫健委等8部门联合印发《北京市提升家庭医生签约服务质量与规模工作方案》。《方案》提出,通过增加家庭医生签约服务供给、优化家庭医生签约服务、发展互联网﹢家庭医生签约服务等,进一步深化家庭医生签约服务供给侧改革,提升家庭医生签约服务质量与规模,增强签约居民获得感。
2.WHO发布最新宫颈癌筛查指南。当地时间7月6日,世卫组织发布最新的宫颈癌前病变筛查和治疗指南。此次指南更新共包括23项推荐和7项筛查管理规范(good practice)声明。尤为值得关注的是,新指南推荐HPV DNA检测作为筛查的首选方法,而不是目前广泛使用的醋酸染色目视观察(VIA)或细胞学检查(也常称为“巴氏涂片”)。
3.4种药品转为非处方药。根据《处方药与非处方药分类管理办法(试行)》的规定,并经相关专家论证和审定,国家药监局7月7日发布公告,宣布将疏风解毒胶囊、清开灵泡腾片、黄氏响声茶、黄氏响声含片4种药品转为非处方药,并同时公布非处方药说明书范本。非处方药说明书范本规定内容之外的说明书其他内容按原批准证明文件执行。
审评动向
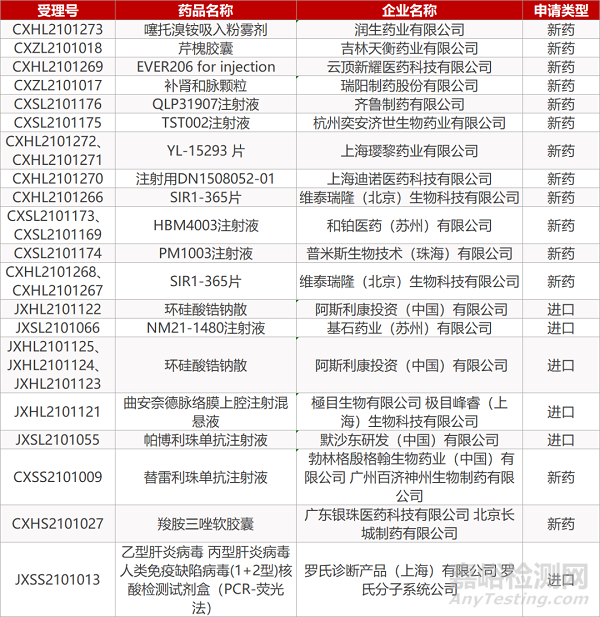
暂无

来源:药研发


