您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-12-07 11:26
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
1.君实/礼来新冠鸡尾酒获批全年龄段适用。FDA日前进一步扩大君实生物与礼来联合开发的埃特司韦单抗(etesevimab,JS016)及巴尼韦单抗(bamlanivimab,LY-CoV555)双抗体疗法的紧急使用授权范围,新增用于特定高风险儿科人群(从出生至12岁以下)的轻中度新冠病毒肺炎治疗及暴露后预防。至此,该组合成为全球首个且唯一获得紧急使用授权,用于全年龄段的高风险人群预防和治疗新冠病毒的感染。
2.腾盛博药新冠鸡尾酒Ⅲ期临床积极。腾盛博药宣布其新冠中和抗体联合疗法(安巴韦单抗/罗米司韦单抗,BRII-196/BRII-198)Ⅲ期临床ACTIV-2结果积极。所有受试者随访28天的主要终点评估及关键性数据分析说明与中期分析结果及结论一致,在疾病进展高风险的COVID-19门诊患者中,这一联合疗法可使住院及死亡的复合终点降低80%,具有统计学显著意义。目前该公司正在检测联合疗法针对奥密克戎变异株的中和活性。
3.加科思KRAS G12C抑制剂获批临床。加科思自主研发的KRAS G12C抑制剂JAB-21822获国家药监局临床试验默示许可,拟联合西妥昔单抗用于KRAS p.G12C突变的晚期实体瘤(包括晚期结直肠癌)的治疗。临床前研究显示,这一组合可增强JAB-21822抑制剂在结直肠癌肿瘤模型中抗肿瘤活性。JAB-21822目前已在中美两国获批5项临床试验,适应症包括非小细胞肺癌、结直肠癌等KRAS G12C突变的晚期实体瘤。
4.药捷安康S1P1靶向新药获批临床。药捷安康1类新药TT-01688-CL片获国家药监局临床试验默示许可,拟临床用于治疗中重度活动性溃疡性结肠炎。TT-01688是韩国LG Chem公司开发的一款S1P1受体调节剂,药捷安康拥有这款自身免疫性疾病治疗产品在大中华地区所有适应症的开发及商业化权益。TT-01688-CL已在韩国完成Ⅰ期临床试验,其临床前研究和早期临床结果均显示该新药对S1P1具有高度的选择性。
5.君实生物CD112R单抗报IND。君实生物治疗用生物制品1类新药JS009注射液的临床试验申请获CDE受理,拟用于晚期恶性肿瘤的治疗。JS009通过高特异性地结合CD112R,有效阻断CD112R与其配体CD112信号通路,进而促进T细胞和NK细胞的活化和增殖,增强免疫系统杀伤肿瘤细胞的能力。同时JS009选择了IgG4亚型,可降低抗体依赖的细胞介导的细胞毒性作用(ADCC)和补体依赖的细胞毒性(CDC)。JS009是国内首个申报临床的CD112R单抗,目前国内外尚无同靶点产品获批上市。
国际药讯
1.安进银屑病新药Ⅲ期临床积极。安进口服PDE4抑制剂Otezla(apremilast)治疗中重度生殖器银屑病和中重度斑块银屑病的Ⅲ期临床Discreet达到主要和次要终点。与安慰剂相比,Otezla治疗组患者在sPGA-G反应方面取得统计学意义的显著改善;而且患者在瘙痒测量、受影响的体表面积、生活质量等指标上也出现显著改善。详细结果预计在明年上半年获得。Otezla此前已获FDA批准用于治疗中重度斑块型银屑病、银屑病关节炎和白塞病。今年2月,Otezla已向FDA提交sNDA申请。
2.默沙东15价肺炎球菌疫苗获优先审评资格。默沙东15价肺炎球菌结合疫苗Vaxneuvance的补充生物制品许可申请(sBLA)获FDA授予优先审评资格,用于帮助6周至17岁儿童预防由疫苗中所含肺炎链球菌血清型引起的侵袭性疾病。Vaxneuvance是由与CRM197载体蛋白结合的肺炎链球菌血清型1、3、4、5、6A、6B、7F、9V、14、18C、19A、19F、22F、23F和33F纯化荚膜多糖组成,此前已获FDA批准上市,用于18岁以上成人预防侵袭性肺炎球菌导致的疾病。
3.BMS贫血疗法获FDA优先审评资格。百时美施贵宝旗下新基公司开发的FIC血红细胞成熟剂Reblozyl(luspatercept-aamt)的补充生物制品许可申请(sBLA)获FDA授予优先审评资格,用于治疗非输血依赖性β地中海贫血成人患者。在一项关键性Ⅱ期临床中,Reblozyl使这类患者血红蛋白平均值较基线升高≥1.0 g/d的比例达到77.1%。此前,FDA已批准该药用于治疗输血依赖性β地中海贫血症患者,与某些罕见血液疾病患者出现的贫血。
4.Quell募资加速开发CAR-Treg细胞疗法。Quell公司完成1.56亿美元的B轮融资,以用于推进潜在“first-in-class”抗原特异性CAR-Treg细胞疗法QEL-001的Ⅰ/Ⅱ期临床。该项研究旨在通过诱导持久的免疫耐受,预防肝移植患者的器官排斥反应,使患者不再需要接受终生免疫抑制治疗。预计今年年底开始患者招募。此外,Quell还将利用这笔资金加速其在器官移植、神经炎症和自身免疫性疾病领域的多样化产品管线开发。
5.Blueprint拟收购精准疗法公司Lengo。Blueprint Medicines与Lengo公司达成收购协议,将获得后者拟用于治疗携带EGFR外显子20插入突变的非小细胞肺癌(NSCLC)的潜在“best-in-class”口服精准疗法LNG-451,和其它临床前肿瘤学精准疗法和研究工具。LNG-451具有血脑屏障渗透性特点,旨在抑制所有常见的EGFR外显子20插入变种和肿瘤脑转移问题,并对野生型EGFR和其它脱靶蛋白激酶有很好的选择性。根据协议,Blueprint将支付2.5亿美元前期付款和可能高达2.15亿美元的里程碑付款。
6.细胞疗法公司Acepodia完成新一轮融资。专注于抗体-细胞偶联(ACC)技术开发细胞免疫疗法的Acepodia公司宣布完成1.09亿美元的C轮融资。此轮融资将主要用于推进其现货型NK细胞疗法ACE1702的临床开发。ACE1702目前已在I期临床中获得初步结果,1例实体瘤(晚期HER2阳性肿瘤)患者接受治疗后获得部分缓解,临床中没有发现剂量限制毒性,细胞因子释放综合征,免疫效应细胞相关神经毒性综合征或移植物抗宿主病。
医药热点
1.基因治疗产品长期随访临床指导原则出台。CDE日前发布《基因治疗产品长期随访临床研究技术指导原则》。该指导原则着重阐述基因治疗长期随访临床研究的观察目的、考虑要素、设计实施以及不同基因治疗产品的特殊考虑等相关要求,在为该类产品开展长期随访临床研究提供技术指导,确保及时收集迟发性不良反应的信号,识别并降低这类风险,同时获取这类产品长期安全性和有效性的信息。
2.大湾区国际疫苗创新中心落户深圳。12月4日,大湾区国际疫苗创新中心在中国广东省深圳市坪山区生物医药创新产业园区举办开幕仪式。该创新中心是在中法疫苗创新战略合作框架下由深圳市联合赛诺菲巴斯德共同打造,是中国首个国际化的疫苗创新中心,也是首个以疫苗生态创新为核心的创新中心。它将承载着带动中国疫苗行业全链路创新升级,以及架设中国与全球开展疫苗创新合作桥梁的双重意义。
3.执业药师报考年限缩短。为贯彻落实《政府工作报告》要求,推动降低就业门槛,国家人社部会同国务院有关部门研究制定的《部分准入类职业资格考试工作年限调整方案》于近日在国家人社部官网上进行公示。调整方案中包含执业药师考试条件,药学类、中药类专业大专、本科学历的工作年限要求减少1年。
评审动态
1. CDE新药受理情况(12月06日)
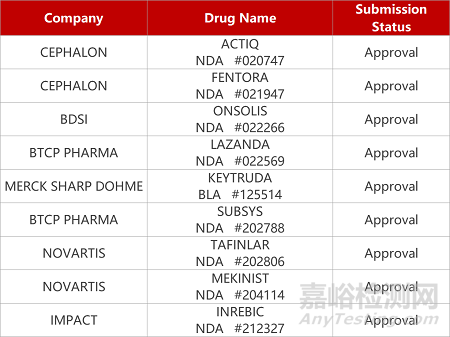
2. FDA新药获批情况(北美12月03日)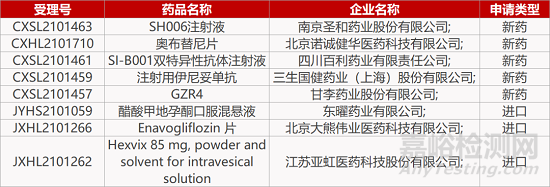

来源:药研发


