您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-12-27 11:25
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
天科雅FIC加载PD-1的TCR-T上临床。天科雅生物“first-in-class”的TCR-T疗法TC-E202注射液登记启动一项Ⅰ期临床,拟评估用于治疗HPV16阳性、复发或转移性宫颈癌经治患者的安全性、耐受性和初步疗效,以及确定II期临床的推荐给药剂量(RPIID)。该项研究将由复旦大学附属肿瘤医院两位医学博士吴小华和张剑共同担任。TC-E202是一种加载抗PD-1抗体的TCR-T疗法,它在编码HPV16 E6 TCR的同时,编码抗PD-1的单链抗体可变区片段。
国内药讯
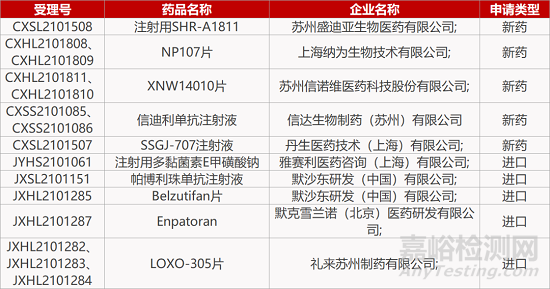
1.江苏晟斯长效凝血因子报NDA。江苏晟斯生物研发的1类新药“注射用重组人凝血因子VIII-Fc融合蛋白”的上市申请获CDE受理。这是一款长效重组凝血因子VIII产品,拟用于先天性凝血因子Ⅷ缺乏的血友病A患者的出血控制和预防治疗。在临床研究中,该疗法可有效降低患者用药频率,而且可以较长时间维持体内较高的凝血因子Ⅷ水平,极大降低自发出血次数。
2.信达PD-1第7项适应症报上市。信达生物PD-1单抗信迪利单抗新适应症上市申请(受理号:CXSS2101085)获CDE受理。推测这项适应症为信迪利单抗注射液联合达攸同(贝伐珠单抗生物类似物)以及化疗用于经EGFR-TKI治疗进展的EGFR突变的局部晚期或转移性非鳞非小细胞肺癌患者。在III期研究(NCT03802240)中,与化疗相比,联合方案显著延长无进展生存期(HR=0.464[95%CI: 0.337, 0.639]; P<0.0001);与达伯舒+化疗相比,联合方案组观察到PFS的提升(HR=0.726, 95%CI: 0.528, 0.998)。
3.康希诺新冠疫苗国际Ⅲ期临床数据发布。康希诺生物在《柳叶刀》发表重组新冠病毒疫苗(5型腺病毒载体)克威莎用于18岁及以上健康人群接种的国际Ⅲ期临床最终有效率和期中安全性分析结果。数据表明,接种1剂克威莎(剂量0.5ml,5x1010 VP/mL)28天后,总体保护率为57.5%,重症保护率为91.7% ;14天后,总体保护率为63.7% ,重症保护率为96.0% 。临床中无一例与疫苗相关的严重不良反应发生。
4.广生堂布局抗新冠小分子口服药。广生堂子公司广生中霖与药明康德就抗新冠病毒小分子口服药3CL蛋白酶抑制剂签订《合作开发合同书》。本次合作开发的3CL蛋白酶抑制剂项目已获得相当药效的预选临床前候选化合物,拥有自主知识产权。在美国,FDA刚刚授予辉瑞的口服治疗新冠肺炎的3CL蛋白酶抑制剂Paxlovid紧急使用授权。值得一提的是,先声药业也在布局同类药品SIM0417。
5.天士力引进FRα-ADC新药。天士力宣布与美国Sutro Biopharma达成合作许可协议,获得靶向叶酸受体α(FRα)的抗体偶联药物STRO-002在中国大陆及港澳台的独家开发和商业化权益。STRO-002是一款第三代抗体偶联药物(ADC),目前在欧美开展针对复发卵巢癌和子宫内膜癌的Ⅰ期临床研究。根据协议,Sutro Biopharma将获得4000万美元首付款,潜在最高3.45亿美元的开发及商业化里程碑付款,以及产品的销售提成。
国际药讯
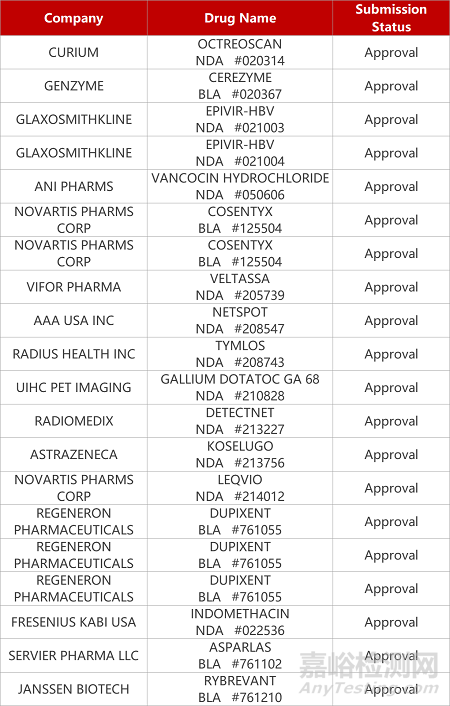
1.默沙东新冠口服药EUA获FDA批准。FDA授予默沙东与Ridgeback Biotherapeutics联合开发的口服抗新冠药物Molnupiravir(MK-4482)紧急授权许可,用于治疗轻中度新冠患者。由于可能影响骨骼和软骨发育,Molnupiravir本次授权范围不包括在18岁以下的年轻人。FDA同时强调,新冠患者应在确诊五日内尽快使用。这是继辉瑞的Paxlovid之后,FDA授权的第二款口服抗新冠疗法。
2.诺华IL-17A抑制剂获批两项儿科适应症。FDA批准诺华IL-17A抑制剂Cosentyx用于治疗四岁及以上的活动性附着点炎相关关节炎(ERA)患者,以及两岁及以上的活动性银屑病关节炎(PsA)患者。在一项III期研究JUNIPERA中,Cosentyx降低了青少年PsA患者的复发风险85%,降低了青少年ERA患者的复发风险53%,其安全性与已知研究保持一致。Cosentyx此前已被批准用于治疗斑块状银屑病、活动性银屑病关节炎和强直性脊柱炎。
3.堕胎药首次在日本报产。Linepharma公司子公司Linepharma KK开发的人工流产药物MEFEEGO™在日本提交上市申请,拟用于妊娠63天以内的药物流产。这是全球首款组合装的米非司酮和米索前列腺药物组合,已被列入世卫组织(WHO)人工流产基本药物清单,被视为国际上早期妊娠药物流产的黄金标准。如果获批,该药物将成为日本首款获批堕胎药物。
4.第一三共HER3-ADC获突破性疗法认定。FDA授予第一三共潜在“first-in-class”的HER3靶向在研抗体偶联药物patritumab deruxtecan(HER3-DXd)突破性疗法认定,用于治疗EGFR突变、转移性或局部晚期非小细胞肺癌经治患者。一项发布在ASCO2021上的Ⅰ期临床数据显示,HER3-DXd(5.6 mg/kg)的客观缓解率达到39%(CI 95%:26-52%),疾病控制率为72%(CI 95%:59-83%),中位无进展生存期为8.2个月,且这一剂量的安全性特征与先前研究一致。
5.QPCT抑制剂治疗AD获快速通道资格。FDA授予Vivoryon公司靶向谷氨酰胺酰肽环转移酶(QPCT)的小分子抑制剂varoglutamstat(PQ912、SIM0408)快速通道资格,用于治疗早期阿尔兹海默症(AD)。在一项IIa期研究中,Varoglutamstat与安慰剂相比,显著改善患者在神经心理量表(Cogstate NTB)中一个代表工作记忆的分量评分;其他指标上如在脑脊液QPCT酶的抑制、脑脊液中的Neurogranin、YKL-40等,也具统计学意义的改善。先声拥有该新药的大中华区权益。
6.FIC单抗两项II/III期研究失败。Allakos公司“first-in-class”抗Siglec-8单抗lirentelimab治疗嗜酸性粒细胞性胃炎(EG)和/或嗜酸性粒细胞性十二指肠炎(EoD)的III期ENIGMA 2研究和治疗嗜酸性粒细胞性食管炎(EoE)的II/III期KRYPTOS研究结果公布。两项研究均达到了组织学共同主要终点,但均未达到改善患者症状的共同主要终点。Sigec-8是一种选择性表达于肥大细胞和嗜酸性粒细胞的抑制性受体。Lirentelimab旨在通过自然杀伤细胞介导的抗体依赖细胞毒性和细胞凋亡来消耗嗜酸性粒细胞。
医药热点
1.WHO“团结试验”正评估第二代新冠疫苗。12月22日,世卫组织总干事谭德塞在新闻发布会上透露,世卫组织正在通过疫苗“团结试验”确定第二代新冠疫苗。目前,独立的疫苗优先级咨询小组已审查了大约20种候选新冠疫苗,并把两种候选疫苗列入“团结试验”。据悉,中国艾棣维欣(苏州)与美国Inovio制药联合开发的新冠脱氧核糖核酸疫苗pGX9501/INO-4800为其中一个正在参加“团结试验”的品种。
2.上海交通大学数字医学研究院成立。上海交通大学数字医学研究院12月21日成立。该研究院旨在围绕“五大中心”建设,即数字医疗研究中心、数字公卫研究中心、数字医药研究中心、数字医学转化中心、监管科学研究中心,打造一流的数字医学科技创新研究高地和产业应用转化基地,培养一流的具有创新思维和国际竞争力的数字医学复合型领军人才,助力上海生物医药和健康产业的高质量发展。
3.北京将履行公卫职责纳入三级医院考核。12月20日,北京市卫健委等7部门联合发布《关于调整三级公立医院绩效考核部分指标的通知》。《通知》明确,将医疗机构履行公共卫生职责纳入医疗机构年度绩效考核,自2021年度开始,北京市三级公立医院绩效考核指标体系中“传染病报告及完整率”调整为“公共卫生综合履职率”。
评审动态

来源:药研发


