您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-02-07 11:33
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
迪哲FIC新药获突破性疗法认定。迪哲医药自主研发的全球首创小分子药DZD9008获FDA突破性疗法认定,拟用于治疗EGFR 20号外显子插入突变的非小细胞肺癌患者。DZD9008是一款针对EGFR/HER2 20号外显子插入突变设计的小分子新药,目前正在中国、美国、韩国、澳大利亚、日本、法国等开展国际II期单臂关键性临床试验。去年12月,CDE已将DZD9008纳入突破性治疗药物品种。
国内药讯
1.泽布替尼两项新适应症报产。百济神州BTK抑制剂百悦泽(泽布替尼)的两项新适应症上市申请获CDE受理,分别用于治疗华氏巨球蛋白血症(WM),及治疗慢性淋巴细胞白血病(CLL)或小淋巴细胞淋巴瘤(SLL)。泽布替尼目前正在全球进行广泛的临床试验,单药或联合用药治疗多种B细胞恶性肿瘤。目前,该药已在全球获得20项批准,适应症覆盖套细胞淋巴瘤、WM、边缘区淋巴瘤等。
2.礼来“地坦类”头痛药在华报产。礼来5.1类新药拉米地坦片(lasmiditan)的上市申请获CDE受理。拉米地坦是一款血清素(5-HT)1F受体激动剂,已于2019年获FDA批准上市,作为急性疗法治疗有先兆或无先兆成年偏头痛患者。该药也是FDA批准的首款“地坦”类药物。在两项Ⅲ期临床(SAMURAI和SPARTAN)中,拉米地坦组与安慰剂组相比,在服药2个小时后患者头痛完全消失的比例显著提高。
3.石药FIC新药获FDA快速通道资格。石药集团首创新药JMT601(CPO107)获FDA授予快速通道资格,用于治疗成人复发或难治弥漫大B细胞淋巴瘤。JMT601是全球首个进入临床开发阶段的具有协同靶向结合效应的双特异性SIRPα融合蛋白,正在美国开展I/II期临床,评估治疗晚期非霍奇金氏淋巴瘤(NHL)(包括弥漫大B细胞淋巴瘤亚群)患者的安全性和有效性。
4.凯思凯迪FXR激动剂国内获批临床。凯思凯迪1类新药CS0159片获国家药监局临床试验默示许可,拟开发用于原发性硬化性胆管炎(PSC)。CS0159是一种非甾体类FXR小分子激动剂,此前已在美国获批开展针对PSC的临床试验。临床前研究表明,CS0159具有强效的FXR激动活性及肝靶向分布的特点,可明显改善3,5-二乙氧基羰基-1,4-二氢三甲基吡啶诱导的小鼠PSC模型的病理状况,而且起效剂量低、药效显著且耐受性良好。
5.强生CD3/22双抗报IND。强生治疗用生物制品1类新药JNJ-75348780(JNJ-8780)注射液的临床试验申请获CDE受理。JNJ-8780是首个在国内申报临床的CD3/CD22双抗,也是全球首个且唯一一个进入临床开发阶段的CD3/CD22双抗。全球范围内,JNJ-8780正处于I期临床阶段,适应症为非霍奇金淋巴瘤和慢性淋巴细胞白血病。
国际药讯
1.第二款mRNA新冠疫苗获FDA批准上市。FDA批准Moderna公司mRNA新冠疫苗Spikevax(mRNA-1273)的生物制品许可申请(BLA),用于在18岁以上个体中预防COVID-19。在临床试验中,Spikevax预防出现症状的COVID-19的有效率为93%,预防严重疾病的有效率达到98%。此前该疫苗已获得FDA的EUA授权,用于在18岁以上人群中预防COVID-19。这是Moderna公司获得FDA批准的首个产品,也是FDA正式批准的第二款mRNA疫苗。
2.HIV复方长效给药方案获批。ViiV Healthcare长效HIV疗法Cabenuva(利匹韦林/卡博特韦)获FDA批准每两个月一次的给药方案,用于治疗接受抗逆转录病毒治疗后,出现病毒学抑制(HIV-1 RNA低于50拷贝/毫升)的HIV-1感染者。Cabenuva是FDA于去年1月批准的首款用于HIV感染患者的完整注射方案,批准方案为每个月给药一次。在一项国际Ⅲb期临床中,每两个月一次用药与每月一次方案相比,患者中血浆HIV-1 RNA≥50拷贝/毫升的患者比例达到非劣效性标准(1.7%vs1.0%)。
3.FDA批准罗氏眼科双抗上市。罗氏旗下基因泰克VEGF-A/Ang-2双抗Vabysmo(faricimab-svoa) 获FDA批准上市,用于治疗湿性年龄相关黄斑变性(wAMD)和糖尿病黄斑水肿(DME)。在两项III期研究TENAYA (NCT03823287) 和LUCERNE (NCT03823300)中,faricimab在治疗第48周的视觉敏锐度(BCVA评分)较基线的改善程度均非劣效于阿柏西普,两项研究中分别改善5.8和6.6个字母,而阿柏西普组为5.1和6.6个字母。Faricimab是针对眼疾获批的首款双抗,也是首个在治疗DME和wAMD的III期研究中达到4个月间隔给药的药物。
4.劳拉替尼获欧盟批准治疗NSCLC。辉瑞Lorviqua(劳拉替尼)新适应症获欧盟委员会批准,用于单药一线治疗ALK阳性非小细胞肺癌(NSCLC)。在关键III期CROWN研究中,与Xalkori相比,劳拉替尼一线治疗使这类患者疾病进展或死亡风险降低72% (HR 0.28,P≤0.0001)。基于CROWN研究结果,劳拉替尼在美国于2018年获FDA加速批准的二线适应症也获批转变为完全批准。
5.辉瑞/BioNTech新冠疫苗拟报儿童EUA。辉瑞与BioNTech联合开发的mRNA新冠疫苗向FDA滚动提交申请,旨在扩展紧急使用授权(EUA),用于6个月-5岁儿童的3剂疫苗接种的前2剂接种。在儿童中进行的临床试验目前已包括约8300名儿童,旨在评估疫苗两剂在三个年龄组(5-12岁,2至5岁以下,6个月至2岁以下)的安全性、耐受性和免疫原性。在Ⅱ/Ⅲ期临床中,5岁以下儿童接种每次3 µg的降低剂量。
6.新冠“人类挑战试验”安全数据公布。Open Orphan公司、英国伦敦帝国理工学院与hVIVO公司联合开展的新冠“人类挑战试验”获得一年期安全数据。36名(18-29岁)健康志愿者通过滴鼻剂感染小剂量的新冠病毒。结果发现,病毒首先出现在喉部,病毒载量达到峰值为五天左右;鼻腔中病毒平均存活时间为6.5天。有18名志愿者被感染(均为非重症),有13名感染者嗅觉暂时失去,其中10人在90天内恢复嗅觉。
7.IL-15激动剂治疗HIV早期临床数据积极。ImmunityBio公司IL-15超级激动剂Anktiva(N-803)治疗HIV感染的Ⅰ期临床结果积极。试验结果显示,Anktiva与CD4阳性和CD8阳性T细胞和NK细胞的增殖和/或活化相关,在给药后4天达到峰值。外周血单核细胞(PBMCs)中具有可诱导HIV前病毒的细胞频率出现小幅但显著的降低,并持续至治疗后6个月。Anktiva最大耐受剂量为6.0 μg/kg。未发生与Anktiva相关的不良事件。相关成果发表在Nature Medicine杂志上。
8.渤健出售三星Bioepis全部股权。渤健日前宣布已与三星生物达成最终协议,将其在三星Bioepis公司的49%股权出售给三星生物。此举将为渤健套现23亿美元。2012年,三星集团旗下三星生物与渤健共同投资成立了三星Bioepis公司,该公司研发管线主要为生物类似药。据悉,交易完成后,两家公司将继续执行之前签署的独家协议,包括将目前的投资组合(依那西普、阿达木单抗、英夫利西单抗)商业化。
医药热点
1.《自然》:2022年值得关注的7大技术。权威科学杂志《自然》发布2022年度值得关注的技术榜单,这些工具有望在2022年对科学研究产生重大影响。它们分别为:完整测序的人类基因组、解析蛋白结构、量子模拟、精准基因编辑组、靶向递送基因疗法、空间多组学和基于CRISPR的诊断检测。
2.2022年医药行业预测涨薪率为6.20%。薪智日前发布《2022年薪酬白皮书》。《白皮书》显示,2022年医药行业预测涨薪率为6.20%;跳槽涨薪率最高的十个城市为上海、北京、深圳、广州、苏州、天津、杭州、重庆、南京、厦门,其中上海跳槽涨薪率为48.14%。针对应届毕业,一线城市:博士学历的起薪最高为27700元/月,大专学历起薪最高为8600元/月;二线城市:博士学历的起薪为最高23600元/月,大专学历的起薪最高为5800元/月。
3.《“十四五”医药工业发展规划》发布。1月30日,国家九部门印发《“十四五”医药工业发展规划》。与“十三五”《医药工业发展规划》相比,覆盖面进一步拓宽,增加了3个编制部门:国家医保局、应急管理局、国家中医药管理局。《规划》还提出“十四五”期间医药工业营业收入、利润总额年均增速保持在8%以上;全行业研发投入年均增长10%以上等六项具体目标和四项保障措施。
评审动态
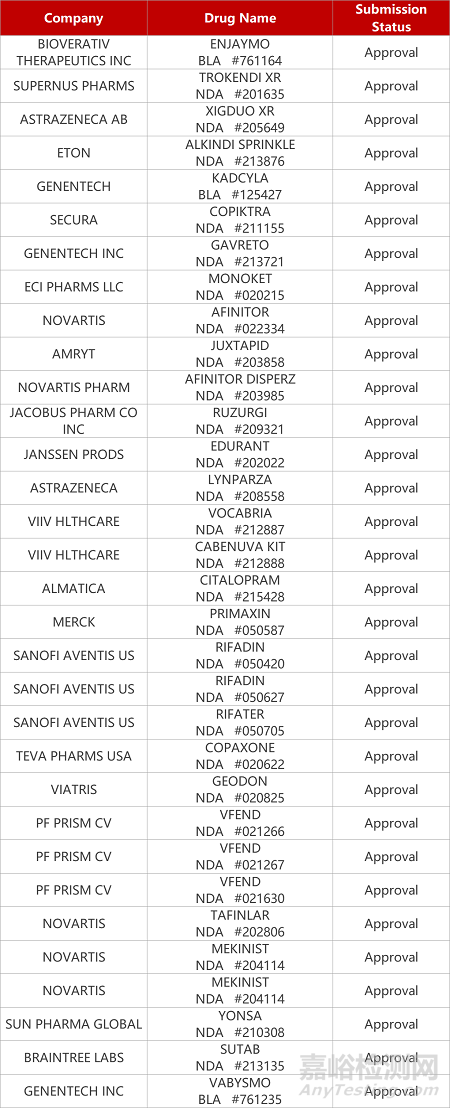
2. FDA新药获批情况(北美02月04日)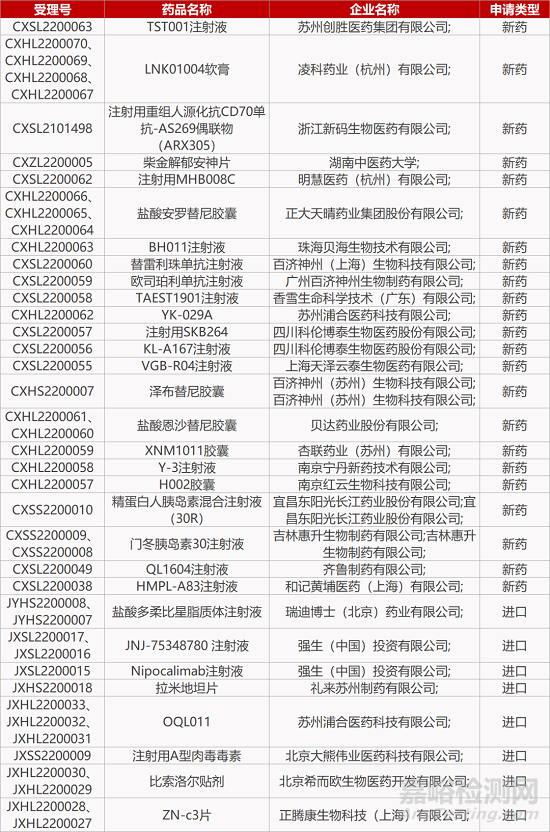

来源:药研发


