您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2022-08-10 16:07

国家药监局药审中心消息,以患者为中心”的药物研发理念已成为当前药物研发的核心指导思想。为了指导以患者为中心的临床试验,起草了3个以患者为中心的临床试验相关指导原则,并向社会征求意见,全文如下
以患者为中心的临床试验获益-风险评估技术指导原则
一、引言
作为药物临床试验的受试者和医疗实践的对象,患者对疾病状态和治疗有亲身体会,可为药物研发提供更贴近患者期望、更有价值的信息。“以患者为中心”的药物研发,是指以患者需求为出发点、视患者为主动参与者、以临床价值为最终目的,该理念已成为当前药物研发的核心指导思想。审评机构正在探索如何设计和实施“以患者为中心”的药物临床试验,并将患者需求纳入到药物的获益-风险评估体系中。
患者体验数据(patient experience data, PED)是指所有由患者端(但不限于患者本人)提供的有关患者对疾病和治疗的体验、需求、观点、偏好等信息。有意义的患者体验数据可以作为药物获益和风险评估的科学依据之一。
本指导原则旨在阐明患者体验数据的定义、分类,和基于患者体验数据进行获益-风险评估的适用范围、科学考量、与审评机构的沟通等,为申办者如何运用患者体验数据支持上市注册申请及全生命周期的获益-风险评估提供参考。
本指导原则仅代表药品审评机构当前的观点和认识,不具有强制性的法律约束力。随着科学研究的进展,本指导原则中的相关内容将不断完善与更新。应用本指导原则时,请同时参考药物国际人用药品注册技术协调会(ICH)和其他已发布的相关指导原则。
二、一般原则
药物的获益-风险评估一般应基于一系列有效性和安全性证据。可靠的患者体验数据可作为获益-风险评估的证据之一,用于发现未满足的临床需求、识别目标患者群体、确认临床试验设计的关键要素、确定终点评估的临床意义、评估患者的获益偏好及对风险的接受度等。
PED在获益-风险评估中的适用性及适用范围,取决于PED的类型、采集目的、研究设计、收集场景、数据质量、对结果的可解释性等。一般而言,使用方法学合理的(methodologically-sound)和适合目的(fit-for-purpose)的收集工具获得的PED,可以为获益-风险评估提供直接证据。所谓方法学合理性,即保证用于收集和分析PED的方法和过程是严格的、稳健的,并遵守科学上既定的原则和最佳实践方法;所谓适合目的,即研究设计、患者群体和研究方法的选择与该数据的预期用途之间相匹配。当PED作为关键性证据(或之一)支持获益-风险评估时,需要提前与审评机构沟通,确保数据通过预先设计的研究收集,该研究有预先设定的研究方案和分析计划,并确保纳入样本的代表性、数据采集的规范性,以及数据的可靠性、完整性和科学性。
PED的收集过程是动态的、逐步深入的。在药物立项和早期临床阶段,PED数据多为定性的,收集内容多针对患者对于疾病和现有治疗的观点。伴随着研发的深入,PED的收集可加入定量的方法,逐渐聚焦到患者对于特定药物预期获益的观点,包括获益和风险的权衡。当药品上市后,可根据需要不断收集真实世界中药品使用的PED,用以达到将患者获益最大化和风险最小化的最终目标。
三、患者体验数据的分类
患者体验数据的分类方法多样。根据PED的来源,可分为申办方收集、或非申办方收集。根据PED的收集方法,可分为预先设计的临床试验、患者偏好研究、自然病史研究、访谈、问卷、专家咨询、患者交流会议总结等。PED的数据性质包括定性、半定量或定量。PED在获益-风险评估中的主要用途,包括临床结局评估(clinical outcome assessment, COA)、对获益和/或风险的患者偏好信息(patient preference information,PPI),以及其它对于疾病及治疗的见解、需求或优先关注等。以下分别介绍COA和PPI相关内容。
(一)临床结局评估(COA)
临床结局评估(clinical outcome assessment, COA)是来自患者及其照护者、医生或其他评估人员,用于评价患者个体感受、功能或生存状态的评估工具或手段,通常需要主观评估过程而非直接的事实呈现。COA的评估维度包括症状、日常功能、总体健康状态、生活质量及满意度等。根据报告者类型或评估方法,基于COA的临床终点可分为四种类型,包括患者报告结局(patient-reported outcome,PRO)、临床医生报告结局(clinician reported outcome,ClinRO)、观察者报告结局(observer-reported outcome,ObsRO)和功能结局(performance outcome,PerfO)。
PRO是直接由患者本人报告的健康状况的测量,未经医生或其他人的外部修正和解释。PRO工具通常包括问卷调查、数字评分表或患者日志等。例如,使用 10 分制视觉模拟疼痛量表(visual analog scale, VAS)、健康调查简表(the 36-item short from health survey, SF-36)。ClinRO是专业医护人员基于检查或观察到的患者疾病和健康状态的测量结果,多涉及对于患者体征、行为或疾病相关的其他现象的临床判断或基于实验室指标的临床判断。例如,系统性红斑狼疮疾病的严重活动评分(SLEDAI-2K)、汉密尔顿抑郁量表(HAMD)。ObsRO是由在日常生活中照护者报告的患者健康状况结果的测量。例如,儿童Dravet综合征的癫痫发作频率日记。PerfO是患者完成一项标准化的功能任务时,由经过适当培训的人员或患者独自评估的测量值。例如,步行速度测定(如6分钟步行试验,6MWT)、记忆重现试验(如单词回忆测验)或其他的认知试验(如数字符号替换测验)等。
基于COA的临床终点可作为评价临床获益的主要终点(单或复合终点)或预先定义的次要终点。临床获益定义为治疗或干预措施对患者个体感受、功能或生存的改善。例如,遗传性血管性水肿的临床试验中可以采用基于复合视觉症状评估(Visual Symptom Assessment,VAS)评分的症状缓解时间作为主要终点。在骨髓纤维化适应症的关键临床试验中,以影像学结果(脾体积缩小)作为主要终点,并将患者日记采集的改良骨髓纤维化症状评分表(MFSAF)中的症状改善作为关键次要PRO终点。此外,安全性和风险的耐受性亦可通过COA来评估。例如,视觉症状评估问卷 (Visual Symptom Assessment Questionnaire [VSAQ-ALK])是一项PRO工具,既用于评估与视力相关的症状,也被用作评估非小细胞肺癌的安全性结局,被撰写入在说明书中。
(二)患者偏好信息
患者偏好信息(patient preference information,PPI)是指患者针对特定治疗的不同临床结局或其他特性的选择意愿和接受程度的定性或定量的评估。在获益-风险评估中,PPI可以提供患者对于获益的偏好和对于风险的容忍度。例如,询问接受不同治疗的患者对特定疗法的使用倾向(如对于外用、口服和注射药物的使用倾向),或询问患者是否为了换取可能获益而接受风险的意愿(如可接受生存质量折损多少,以换取一定程度的生存时间延长)。
在药物研发的不同阶段,PPI可能对于治疗背景、终点选择和动态获益-风险评价等方面都有指导作用。PPI有助于明确获益(即试验终点)对于患者的重要性,了解患者对于特定药物的获益和风险的权衡,了解患者群体对于各种治疗方案的选择倾向和异质性。
PPI在获益-风险评估中的应用,需充分考虑适应症背景、PPI对于适应症评估的价值、PPI的收集方法及收集的患者观点代表性。对于以下几种情况,在进行获益-风险评估时需慎重考虑PPI是否确有价值:(1)药物在疗效明确的前提下,存在严重风险或风险不确定性,而PPI提示患者愿意承受更高的风险以获得可能的获益;(2)受试人群中,不同患者对于最重要的获益和/或风险的观点有较大差异;(3)患者观点与医疗专业人员观点不一致。一般来说,对于疗效不佳或存在严重安全性问题的药物,不能仅依据PPI进行获益-风险评估。
四、患者体验数据支持获益-风险评估
(一)获益风险评估的重要因素概述
获益-风险评估为药物获益和风险的权衡。获益包括临床获益和其他方面的获益(如用药便利性、依从性等);风险是指与药物相关的不良事件和其他不利影响。
获益-风险评估从以下几个方面进行(见表1):“治疗背景分析”(疾病的发病情况、严重性与预后、现有可用疗法的特点、未满足临床需求等)、具体药物“获益”和“风险及风险管理”。对上述每个方面均需要评估相关的证据(包括数据质量和可信度)以及不确定因素及其潜在影响。最后,综合有关药物获益和风险的证据和不确定性,并结合疾病的严重程度和当前未满足的临床需求,得出获益风险评估的具体结论。
表1. 以患者为中心的获益-风险评估框架
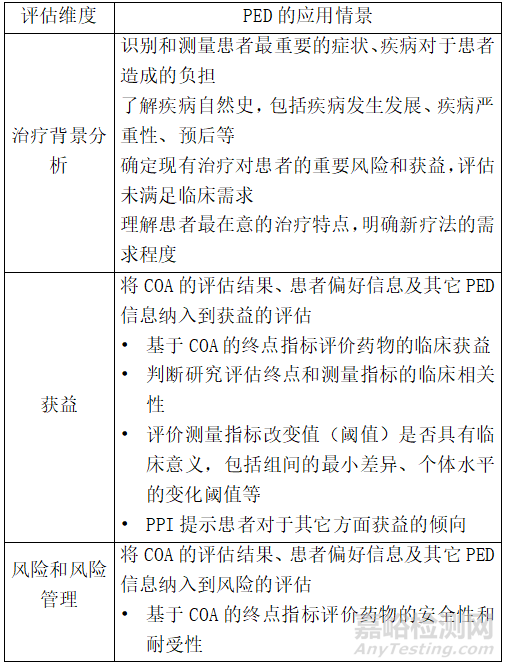

(二)患者体验数据支持获益风险评估
在获益-风险评估中,患者的体验数据可以为以下一系列考量指标提供有用的信息,例如疾病的自然史、主要症状、对患者生活的影响、患者对治疗的体验或对未满足需求的看法、疾病管理的优先次序、患者或相关照护者报告的结局、患者对治疗方案或结局指标的偏好等(详见表1)。根据数据采集的目的、数据类型和数据质量,PED的适用范围和作用不尽相同。
1.药物使用的治疗背景
PED可以提供患者对于疾病影响及现有治疗体验的观点。例如,PED有助于更清晰地理解疾病对患者的影响,哪些症状和体征是患者最在意的、最困扰的、最影响日常生活质量的;了解患者的疾病负担和症状的影响。PED亦有助于了解目前可用治疗方法对患者群体的医疗需求的满足程度,以及对于新疗法的需求程度,包括有效性、安全性、耐受性、便利性、可及性等。
对于影响发病机制、临床症状和临床获益的评价指标尚未被充分知晓的疾病,PED数据亦有助于深入了解疾病的自然史。例如,某些罕见疾病的发病率低、表型复杂,且临床诊疗有效性等方面的认知有限,对新药研发的临床试验设计和有效性评估带来很大挑战。作为疾病最有发言权的患者及其家属,他们的体验和观点可为疾病发生发展、疾病严重性、预后等方面的评估提供参考。
2.药物获益-风险的证据
PED可以对临床研究评估终点的临床相关性、获益和风险的临床意义、风险的耐受度和接受性等角度提供患者观点。
2.1 研究终点的临床相关性
临床获益的描述通常包括有效性(如生存率、严重临床结果的变化、症状的减轻、功能的改善)、效应大小(effect size)和相关的不确定性(如置信区间),治疗效果在人群中的分布情况、疗效持续时间等。对于有效性测量指标的选择,建议根据目前对于疾病的认知以及已获得的患者体验数据,判断临床终点和测量指标的临床相关性,即是否为患者最在意或对患者影响最大的临床指标,或该测量指标是否可预测临床获益。
对于以直接(或相对直接)测量临床获益(如症状的减轻、功能的改善、生存质量的提高)为研究终点的临床试验,可以选择基于COA的终点指标。该指标如作为主要或关键次要终点指标,应充分说明选择依据,并提供COA数据的采集方式、度量性能(如信度、效度)、详尽数据分析及结果判读。
除临床获益外,其他方面的获益(例如,用药便利性、依从性等)亦可能成为患者的偏好,在获益-风险评估中占有一定权重。
2.2 获益和风险的临床意义
临床获益和潜在风险除了考虑获益程度和风险大小外,还需要探讨这种程度和大小是否具有临床意义、患者如何看待这些临床意义等,这亦是以患者为中心的获益风险评估的重要考量因素之一。
有临床意义的最小差别(minimum clinically important difference, MCID)设定了具有临床价值的获益阈值,代表了患者认为有价值的最小改善。在确定 MCID 时,应充分考虑相关指南、专家共识等公认的标准;若暂无公认的标准,则需通过收集的PED设定有临床意义的变化量,并与审评机构及时沟通交流以达成共识。
当组间显示有意义的差异时,并不代表个体获得有意义的临床获益。还需预设一个有临床意义的患者个体内的指标变化阈值(clinically meaningful within-patient change),对患者是否达到治疗目标进行判断,该值可作为评价获益的支持性证据。可选的方法包括锚定法、基于分布的方法等。
2.3风险的耐受度和接受度
在判断药物风险时,应考虑不良事件的严重程度、发生频率、可逆性和耐受性的特征,以及不良事件对药物依从性的影响和潜在后果。PED可以是安全性结局本身(COA作为安全性终点),也可作为其它支持性证据,如风险知情情况(患者是否理解每种类型的风险和风险发生的可能性)、临床重要性(患者认为哪个风险对于生活的影响最大)、不良反应的耐受性、以及风险管理措施对患者造成的负担等。
患者偏好数据还可提供患者风险接受程度的信息,即基于临床获益的可能性,患者是否愿意接受可能的风险。例如,患有严重危及生命疾病的患者可能愿意承受更大的风险以换取特定的受益(如仅延长生命几个月);而某些慢性疾病患者,现有治疗方案可稳定病情,患者已适应所患疾病及其对日常生活的影响,与现有治疗相比,对新治疗方案可能会期待更大的受益,而不可承受较高的风险。
3.药物获益-风险评估
当药物有明确的临床获益,且安全性特征良好、未发现严重的安全性风险时,可判断其获益大于风险。
当药物有明确的临床获益、但存在安全性风险时,需权衡获益-风险比,考虑是否有有效的风险管理措施可控制风险。
当药物存在潜在的严重安全风险(如危及生命等)和/或可能的获益有限时,获益-风险评估会具挑战性。在这种情况下,符合特定目的且可靠的患者体验数据,对评估药物获益-风险将有所助益。整体人群的获益-风险评估是对临床试验受试者的整体评价;而亚组评估是针对部分患者亚组的评估。当整体获益-风险评估与亚组评估之间存在不一致时,需要仔细权衡来自两部分的支持性数据,亦可纳入患者的观点。例如,经评估药物对整体适应症人群的预期风险超过获益时,如果PED能够帮助识别具有良好获益风险比的亚组人群,则可在后续研发中以该人群为试验对象开展研究,以证明药物是否在该人群具有有利的获益-风险比。
(三)患者体验数据支持药物全生命周期的获益风险评估
1.上市前研发阶段
患者体验数据的收集和应用是一个积累的过程。临床开发过程中,患者体验数据的不断积累,用以指导更广泛的获益-风险评估,从而支持药物研发继续/终止的决策。
早期收集的PED多以定性数据为主,可为获益-风险评估和药物开发决策提供的信息包括发现未满足的临床需求、确定目标患者群体、确定试验设计的关键要素等。例如,临床开发早期收集的PED可以开放式提问的方式,了解疾病的自然病史、临床实践的偏好、患者亚群的差异等,从而识别未满足的患者需求,确定目标患者群体。
随着PED的不断积累,后期对于使用患者体验数据的范围逐渐聚焦,方法逐渐定量化。例如,开发定量的COA工具,以更直接地测量对患者最关注的临床结局,并验证该工具的临床相关性,确定有临床意义的变化阈值;收集定量的患者偏好信息以判断患者的使用意愿和对于风险的接受程度。这些后期收集的定量PED信息可作为临床有效性和安全性数据的直接证据或补充信息,支持动态地评估获益风险。当面临重大开发决策需要与审评机构讨论时,PED的收集与应用也可作为与审评机构沟通交流的重要内容之一。
2.上市后使用阶段
药品上市后使用期间,应根据不断积累的新信息(包括PED),重新评估药品的获益风险状态,从而决定是否采取相应监管措施,包括修改风险管理计划、增加上市后研究要求、说明书变更或撤市等,以期将患者获益最大化、将风险最小化。鼓励上市后收集更多的PED,这类信息可以由申办者为回应特定的上市后要求为目的而收集,也可以通过申办者、研究者或患者组织自愿发起的各类研究(如访谈、问卷调研、患者使用偏好研究等)而收集。这些患者体验数据既可以真实地向广大患者、医护人员和相关人员传达反映患者关于药物使用的体验和感受,也可以为获益风险的动态评估提供新证据。
五、沟通交流
当申办者计划收集和利用患者体验数据作为获益-风险评估的一部分时,鼓励在这类研究的设计阶段与审评机构早期沟通,以获得关于研究设计、数据采集和监管是否符合要求的及时反馈。当申办者计划采用PRO或其它COA作为确证性研究的主要或关键次要终点时,应与审评机构及时沟通。另外,在临床试验过程中,如果因为更改PRO或其它COA而使临床试验方案做出重大调整,应与审评机构及时沟通。具体参见《药物研发与技术审评沟通交流办法》《患者报告结局在药物临床研究中应用的指导原则(试行)》《以患者为中心的临床试验设计指导原则》等相关指导原则。
六、结语
“以患者为中心”的研发理念应贯穿于药物研发的全生命周期。药物研发过程中,应不断收集和纳入患者体验数据,以优化药物开发计划和临床试验设计方案,将完整临床证据链与患者体验数据相结合,实现全生命周期的获益-风险动态评估,并从患者的角度出发来评估药物获益-风险比。
本指导原则鼓励申办者或其他参与方积极收集患者观点和体验,以加深对疾病的理解、增加对于药物使用的认识、以及患者对于获益和风险的需求。PED支持药物研发和评价目前尚处于探索阶段,缺乏统一的分类方法、明确的研究路径和应用原则。国外已实行的措施需要结合我国的文化背景、患者接受度和中国实际情况等因素进一步实现本土化。对于本指导原则未能覆盖的问题,鼓励申请人积极探索开发和完善PED收集工具和分析方法,积极与审评机构进行沟通交流,在符合科学性并具有可操作性的原则下,增加对患者体验的关注,并将其应用到以患者为中心的药物研发和评价中。
七、参考文献
[1] FDA Guidance 1-4:Patient-Focused Drug Development.
[2] FDA Benefit-Risk Assessment for New Drug and Biological Products Guidance for Industry DRAFT GUIDANCE.
[3] Guidance for Industry Patient-Reported Outcome Measures: Use in Medical Product Development to Support Labeling Claims.
[4] 《患者报告结局在药物临床研发中应用的指导原则(试行)》(2022年1月4日).
[5] FDA Perspective on Clinical Outcome Assessments IMMPACT XX Meeting July 13, 2017. Patient Preference Information-Voluntary Submission, Review in Premarket Approval Applications, Humanitarian Device Exemption Applications, and De Novo Requests, and Inclusion in Decision Summaries and Device Labeling.
[6] Assessment of the Use of Patient Experience Data in Regulatory Decision-Making. Eastern Research Group, Inc. June 18, 2021.
[7] 萧惠来.FDA《新药和生物制品的获益-风险评估供企业用的指导原则》介绍[J].药物评价研究,2022,45(02):210-220.
[8] 左书凝, 何春俐, 赵建中. 药物评价中的获益风险评估[J]. 中国临床药理学杂志, 2021, 37(13):7.
[9] Johnson F R, Zhou M. Patient preferences in regulatory benefit-risk assessments: a US perspective[J]. Value in Health, 2016, 19(6): 741-745.
[10] Holmes E A F, Plumpton C, Baker G A, et al. Patient‐Focused Drug Development Methods for Benefit–Risk Assessments: A Case Study Using a Discrete Choice Experiment for Antiepileptic Drugs[J]. Clinical Pharmacology & Therapeutics, 2019, 105(3): 672-683.
[11] Chachoua L, Dabbous M, François C, et al. Use of patient preference information in benefit–risk assessment, health technology assessment, and pricing and reimbursement decisions: a systematic literature review of attempts and initiatives[J]. Frontiers in Medicine, 2020: 682.
[12] Mühlbacher A C, Juhnke C, Beyer A R, et al. Patient-focused benefit-risk analysis to inform regulatory decisions: the European Union perspective[J]. Value in Health, 2016, 19(6): 734-740.
[13] Johnson F R, Zhou M. Patient preferences in regulatory benefit-risk assessments: a US perspective[J]. Value in Health, 2016, 19(6): 741-745.
[14] FDA-NIH Biomarker Working Group BEST (Biomarkers, Endpoints, and other Tools) Resource Last Updated: May 2, 2018.
[15] 石莉, 梁文, 金丹,等. 浅谈患者偏好在医疗器械产品受益-风险评估中的应用[J]. 中国医疗器械信息, 2020, 26(19):3.
[16] 孙昱、文海若、汪祺. 以患者为中心的药物研发策略[J]. 药物评价研究, 2020, 43(9):9.
[17] 刘炳林, 薛斐然. 临床试验中疗效指标观察与测量相关问题的考虑[J]. 中国新药杂志, 2019, 28(24):9.
[18] Ho MP, Gonzalez JM, Lerner HP, et al. Incorporating patient-preference evidence into regulatory decision making.Surg Endosc. 2015, 29(10):2984-2993.
[19] Gnanasakthy A , Margaret Mordin M S , Clark M , et al. A review of patient-reported outcome labels in the United States: 2006 to 2010.[J]. Value in Health, 2012, 15( 3):437-442.
[20] Ari Gnanasakthy M, Margaret Mordin M S , Mpa E E , et al. A Review of Patient-Reported Outcome Labeling in the United States (2011–2015)[J]. Value in Health, 2017, 20( 3):420-429.
[21] Gnanasakthy A, Barrett A , Evans E , et al. A Review of Patient-Reported Outcomes Labeling for Oncology Drugs Approved by the FDA and the EMA (2012-2016)[J]. Value in Health, 2019, 22(2):203-209.
[22] FDA: Developing and Submitting Proposed Draft Guidance Relating to Patient Experience Data Guidance for Industry and Other Stakeholders.
“以患者为中心”的药物研发是指以患者需求为出发点、视患者为主动参与者、以临床价值为最终目的,该理念已成为当前药物研发的核心指导思想。为了指导以患者为中心的临床试验的设计,即不断了解患者需求,在符合科学性的原则下将有意义的患者体验数据纳入临床试验设计要素的考量中,并充分关注受试者的感受,我中心起草了《以患者为中心的临床试验设计技术指导原则(征求意见稿)》,旨在阐明以患者为中心的临床试验的一般原则、整体研发计划、以患者为中心的临床试验设计要素和其他考量,为临床试验设计提供指引和参考。经中心内部讨论,已形成征求意见稿。
我们诚挚地欢迎社会各界对征求意见稿提出宝贵意见和建议,并及时反馈给我们,以便后续完善。征求意见时限为自发布之日起1个月。
您的反馈意见请发到以下联系人的邮箱:
联系人:陈颖,唐崇淇
联系方式:cheny@cde.org.cn,tangchq@cde.org.cn
感谢您的参与和大力支持。
国家药品监督管理局药品审评中心
2022年8月9日
以患者为中心的临床试验设计技术指导原则
一、 引言
作为药物临床试验的受试者和医疗实践的对象,患者对疾病状态和治疗有亲身体会,可为药物研发提供更贴近患者群体期望和有价值的信息。“以患者为中心”的药物研发是指以患者需求为出发点、视患者为主动参与者、以临床价值为最终目的,该理念已成为当前药物研发的核心指导思想。监管机构正在探索如何设计和实施“以患者为中心”的药物临床试验,并将患者需求纳入药物的获益-风险评估体系中。
患者体验数据(patient experience data, PED)是指所有由患者端(但不限患者本人)提供的有关患者对疾病和治疗的经验、需求、观点、偏好等信息。在临床试验设计中落实“以患者为中心”的理念,应不断了解患者需求,在符合科学性的原则下将有意义的患者体验数据纳入临床试验设计要素的考量中,充分体现患者的临床获益,并关注其参与临床试验的感受,而不仅将患者视作按照方案被动完成临床试验的受试者。
本指导原则旨在阐明以患者为中心的临床试验设计的一般原则,说明以患者为中心的整体临床研发计划和试验设计关键要素、如何收集患者体验数据,以及与审评机构沟通的重要内容等,为申办者在药物临床研发中落实以患者为中心的理念提供参考。
本指导原则仅代表药品监管部门当前的观点和认识,不具有强制性的法律约束力。随着科学研究的进展,本指导原则中的相关内容将不断完善与更新。应用本指导原则时,请同时参考药物临床试验质量管理规范(GCP)、国际人用药品注册技术协调会(ICH)和其他已发布的相关指导原则。
二、 一般原则
以患者为中心的临床试验设计,仍应满足临床试验设计的一般原则。建议同时参考ICH 系列指南和国家药监局出台的《药物临床试验的一般考虑指导原则》,以及针对特定疾病药物研发的技术指导原则等。从以患者为中心的角度出发,应重点关注以下原则:
1.将患者需求贯穿药物研发全程
鼓励申办者从药物研发早期开始,在整个研发生命周期中持续倾听、吸收患者的观点,根据实际需要收集患者体验数据,从而了解未满足的临床需求和重要的临床结局。
2.体现患者需求的临床试验设计
临床试验的研究目的、目标人群、对照选择、安全有效性评价方法等要素的选择,应从患者的角度出发。在临床试验中采用适用于目的(fit-for-purpose)的设计,将患者体验数据纳入到临床试验设计关键要素的考量中。总体研究设计应充分体现患者在身心感受、功能和生存状态等方面的临床获益,从而为研发和监管决策提供依据。
3.改善受试者体验、减轻受试者负担
临床试验设计应充分考虑临床试验受试者的感受,采用受试者易于接受的设计。在保障科学性的前提下,通过优化临床试验的设计(例如:给药方式与频率安排,采样/检查时间点安排)和新技术、新方法或新型试验模式(例如远程访视),以此来提高临床试验便利性、减轻受试者负担,从而达到降低脱落率、提升临床试验受试者代表性和依从性的目的。
需要强调的是,以患者为中心的临床试验设计,对于针对任何疾病的任何药物、任何研发阶段都是重要的原则。但整体临床研发计划、试验设计的要素与疾病特点、现有治疗方法、目标人群特点等因素有关,鼓励申办者结合具体情况与审评机构及时、充分沟通。
三、 以患者为中心的临床试验设计的考虑
(一)以患者为中心的临床整体研发计划
在清晰的以终为始的整体研发计划中,贯穿以患者为中心的思想。重要的是,从临床实践中挖掘特定疾病未满足的临床需求,根据已有信息,在充分调研的基础上评估是否需要开展收集患者体验数据的研究以及研究内容,以解决临床研发中重要的科学问题。例如,对于某些发病率低、表型复杂、临床诊疗认知有限的罕见疾病,鼓励在开展药物研发之初,先对拟开发适应症开展临床调研和疾病自然史研究。
在整体研发计划中采取阶段性的研究决策考虑和动态调整。比如,为了支持在关键研究阶段入选人群范围更接近临床目标人群(在某个成人与儿童共患适应症的成人研究中同时纳入12岁以上青少年、在某个可能合并有肝肾功能不全的目标适应症的研究中纳入肝肾功能不全受试者等等),需要在早期阶段,结合临床需求和药物特点,完成相应的非临床和临床研究。再比如,拟用于后期的临床结局评估工具(包括有效性和安全性)应在早期阶段完成探索和验证。
在符合科学性的原则下,优化临床研发策略,从而提高研发效率。例如基于成人数据的儿科适应症外推、建模模拟辅助药物研发、适应性设计等,避免不必要的患者暴露。
(二)收集患者体验数据的研究
1.患者体验数据收集的对象
患者体验数据的收集对象取决于试验药物的研究目的。研究目的决定了目标人群的详细特征,如疾病特征、治疗手段、治疗引起的并发症等因素,应据此设计合适且详尽的患者体验数据收集对象的入排标准。应尽可能提高数据收集对象的代表性。论证代表性的重要因素包括:人口学和社会经济学特征(不同年龄、性别、种族、社会经济状态)、文化背景和语言、教育程度(不同的阅读、书写水平以及叙述能力、计算能力)、临床特征(疾病严重程度、症状和/或功能性影响、合并症、生理和认知能力)等。同时,应关注抽样方法和样本量是否能保证足够的代表性。
2.患者体验数据的内容
申办者应主要关注以下内容的收集:患者对疾病的看法(患者最关注的症状、对生命质量的影响)、患者对于现有治疗的看法(可及性、安全有效方面的局限性、依从性)、未满足的临床需求、患者对于潜在治疗的预期获益和可接受的风险、患者参与药物临床试验的负担及参与药物研发的方式等。
3.收集患者体验数据的研究方法
在确定了数据收集的对象和内容的基础上,根据研究目的选择适宜的定性、定量或二者混合的研究方法。定性方法一般包括深度访谈、观察性研究、开放性提问、视频及音频调研、社交媒体及患者组织声音收集等;定量方法通常包括问卷调查等使用结构化工具生成的数据、自然病史研究等。如需研究多种背景、不同因素之间的影响,可能需要运用定量及定性方法的混合研究,例如首先通过问卷对患者进行调研,了解他们对疾病或病症的体验,然后再进行深度访谈以获得更多信息。
临床研发早期的患者体验研究可以开放式问题为主,帮助确定后续研究中更聚焦的问题范围和评估工具。调研问题的设计应避免不完整、诱导式或不清晰的提问,避免在同一提问中包含多个问题。在收集患者体验数据时,优先考虑直接获取患者本人的陈述,而对于特殊人群可采用适当的研究方法,例如,通过图画或游戏的形式来获取儿童患者群体的体验,通过看护者观察到的患者行为来反映无法自我报告的患者群体的体验。对于不同文化背景的人群,应使用适当的语言,注意文化差异对沟通的影响。
更多关于收集患者体验数据的建议可参考《组织患者参与药物研发的一般考虑指导原则(征求意见稿)》。
(三)以患者为中心的临床试验设计要素
1.以患者需求为导向的研究目的
临床试验的本质是提出重要科学问题并通过适当的设计来回答这些问题(ICH E8-R1)。在确定研究目的时,需考虑疾病的自然史、试验药物的治疗目标、患者偏好信息等。例如,治疗慢性胆汁淤积性肝病的药物一般以改善疾病进展为目的;但是该疾病常伴有瘙痒症状,严重瘙痒显著影响患者的生活质量,在这种情况下,以瘙痒症状作为目标适应症进行新药研发,也可为患者带来临床获益。早期研究收集的患者体验数据,可以为后期临床试验选择贴近患者需求的研究目的提供支持。
2.选择合适的目标人群
在药品研发过程中,申办者应当结合疾病特点、药物作用机制、已知安全性特征、现有治疗等,纳入获益-风险比最优的受试者,并从各方面促进受试者人群的代表性。一方面,纳入最有可能从试验中获益的受试者,以保障受试者的权益。例如,对于缺乏有效的后线治疗手段的疾病,若试验药物疗效尚不明确,则后线治疗患者较一线治疗患者更有可能从中获益。再比如,若作用机制或已有数据表明,试验药物在生物标志物阳性的患者中有明显的疗效,而在标志物阴性的患者中疗效较小甚至没有疗效,则标志物阳性的患者最有可能从试验中获益;而在用于富集受试者的标志物把握度不足、标志物阴性受试者的治疗手段受限的情况下,也可考虑纳入标志物阴性患者。另一方面,不应没有任何科学理由地排除特定人群,包括儿童、老年人、孕妇、器官功能损伤的患者等。前瞻性地积累必要的支持性数据,可以避免在后期临床试验中对研究人群不必要的限制。例如,对于可能合并肝功能不全的慢性肝病适应症、或疾病本身常会对患者肝功能产生影响的罕见疾病,在前期肝功能损害研究数据支持的前提下,在后期临床试验中纳入肝功能不全受试者。对于预期在老年人中广泛应用的药物,在前期数据证明没有额外风险时,临床试验中应纳入足够数量的老年患者,充分代表即将接受该药物治疗的人群。必要时可以考虑采用适应性设计,预先设置调整入排标准的时机。也可以在有效性终点的主要分析中使用较窄的人群作为分析集,而在次要分析中使用更宽的人群。
申办者应采用多种方式促进受试者多样性的实现,包括但不限于:设置充分的临床试验风险管理机制以保护受试者安全,采用易于被患者接受的临床试验设计和实施方式以减轻受试者参与临床试验的负担,加强患者沟通与培训,在高度覆盖目标人群的地区选择研究中心等。更多建议可参考《以患者为中心的临床试验实施技术指导原则(征求意见稿)》。
3.选择对于受试者最佳的对照
临床试验中的对照组选择应充分保障受试者权益,维护受试者的疗效,符合伦理原则。由于公认的标准治疗方案会不断修订,预期适当的对照组选择将随着时间的推移而发生变化。因此,建议在结合患者体验数据,选择当前临床实践中最佳且可及的治疗的基础上,关注其他可用治疗,以及未来一段时间内治疗需求的动态变化,前瞻性地选择对照组。总体而言,应避免将次优治疗作为对照,影响受试者的治疗选择。若在临床试验开展过程中,目标适应症的标准治疗发生变化,应及时告知受试者,保障受试者充分了解其它可选择的治疗手段,并保障患者自主选择是否退出试验的权利。
4.基于临床结局评估的有效性评价
以患者为中心的有效性评价,不应仅关注试验药物对于生存时长、客观指标的改善,而应当同时关注患者身心感受、功能状态和生存状态的获益。可以使用基于临床结局评估(clinical outcome assessment, COA)的有效性评价方法,在临床试验中收集患者体验数据。
4.1 临床结局评估(COA)的定义
COA是来自患者及其照护者、医生或其他评估人员,用于评价患者个体感受、功能或生存状态的评估工具或手段,通常需要主观评估过程而非直接的事实呈现。根据不同报告者,COA分为医生报告结局(ClinRO)、患者报告结局(PRO)、观察者报告结局(ObsRO),还包括基于测试评估患者表现的功能结局(PerfO);具体可参考《以患者为中心的临床试验获益-风险评估技术指导原则(征求意见稿)》。例如,使用数字评分量表(Numeric Rating Scale,NRS)或语言评分量表(Verbal Rating Scale,VRS)来评价患者的症状严重程度,使用六分钟步行试验(6MWT)来测量患者的运动能力,使用心血管事件相关住院频率来评估心血管事件带来的影响等。
在临床试验中使用COA评估关注的结局时,要基于COA测量的变量(例如COA分数)进行精确定义,用作临床试验的终点指标,从而通过统计分析来回答特定的研究问题。对终点指标的精确定义一般包括具体的评估类型、评估时间点、评估方法以及其他相关信息(比如将个体的多项评估整合的方法)。例如:特应性皮炎患者通常有显著的主观症状,在临床试验中可使用评估主观症状的某量表来评价症状的严重程度,而基于量表评分所精确定义的“第12周某量表评分的得分较基线改变的平均值”可作为评价有效性的终点指标之一。
4.2 基于COA的有效性终点的定位
根据前期收集的患者体验数据,结合研究目的、目标适应症的疾病机制、药物作用机理及临床定位等因素,综合考虑是否在关键试验中采用基于COA的主要终点、共同主要终点或关键次要终点,还是仅作为探索性终点。COA的度量性能对于COA用于主要或共同主要终点的情景尤为重要。对于不同疾病,基于COA的终点定位可能有不同考量,并且可能随着对于疾病认知的深入和已有治疗手段的解决程度而改变。因此,应结合具体情况与审评机构进行讨论。一般而言,对于患者的功能、生存状态影响较大的疾病,可能选择基于COA的主要终点或共同主要终点。此外,在评价药物对于患者生存时长的改善时,可以将生存时长和其他重要的临床事件同时作为共同主要终点或纳入复合终点。而有些疾病已建立实验室检查或其他客观指标作为替代指标来评价临床疗效,这种场景下,可能通过患者体验数据来提供其他背景信息或支持性数据。尤其对于需要长期使用的药物,当同类产品的临床特征相似时,COA可以为评估整体获益提供更多依据。
表1 不同应用场景下COA的定位举例
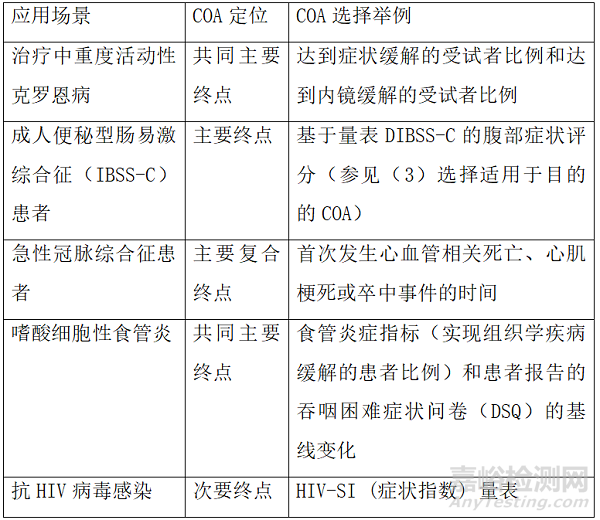
DIBSS-C=Diary for Irritable Bowel Syndrome Symptoms-Constipation
4.3 选择适用于目的的COA
考虑利用现有的文献和数据资源,充分挖掘已有的COA,分析是否能够满足需求,应关注COA开发的历史细节,将其用于最初开发的场景、直接用于新的场景、或经过改良后用于新的场景。例如,罕见疾病往往需要更敏感的测量工具来量化疾病特征,在其它多个治疗领域适用的COA可能并不适用于某些罕见疾病。因此,申办者应考虑验证、慎重应用在其他患者群体中开发的COA。若尚无可用的COA,可考虑开发新的COA。
明确定义COA的评估内容,包括概念、维度和条目及其相互之间的关系。建议评估与目标疾病相关的核心症状/体征,关注疾病核心症状/体征所产生的影响,在必要的情况下可包括多个维度、多个条目。例如:IBS-C患者通常被排便相关肠道症状(如腹泻、难以排出的硬便、里急后重)和腹部症状(如腹胀和腹部不适)所困扰。基于此,COA工具DIBSS-C以核心症状“IBS-C症状的严重程度”作为所评估的概念,包含“排便相关症状”和“腹部症状”两个维度,前者包括排便频率、粪便硬度、里急后重、排便困难4个条目,后者包括腹痛、腹部不适、腹胀3个条目。
根据预期评估的内容和应用场景选择适当的COA类型。对于有症状或功能障碍的病症,一般采用PRO评估,因为它们提供了患者感受和功能体验的直接证据。然而,当患者不能提供自我报告时,往往需要基于观察体征、事件的报告或反映病人感受和功能的行为的报告(例如,ClinRO,ObsRO),不鼓励由其他人代替患者从患者视角进行报告的间接测量方法。在需要临床判断来解释观察结果的情况下,应该使用ClinRO评估,例如评估斑块型银屑病的银屑病皮损面积及严重性指数(PASI)。PerfO测量可用于通过一项或一系列的标准化任务,以标准化的方式评估患者的功能(例如:运动功能和认知功能等)。
对于患者的症状和/或功能状态有较大异质性的疾病(例如,很多罕见疾病表型复杂、临床表现多样化),可能涉及不止一个相关的临床结局,在临床试验中有不同的评估方法,包括:(1)对于多个维度的COA,可采用共同终点/复合终点的形式,例如,以“同时达到症状缓解和内镜缓解(达到临床缓解)的受试者比例”作为溃疡性结肠炎的疗效指标;遗传性血管性水肿患者的症状缓解通过复合VAS评分来评价,定义为非喉部发作的3种症状(腹痛、皮肤疼痛、皮肤水肿)和喉部发作的5种症状(皮肤肿胀、皮肤疼痛、腹部疼痛、吞咽困难和声音改变)。这种情况下,应注意控制I类错误。(2)使用多维度响应者指数(multidomain responder index,MDRI)方法将不同受试者不同的基于COA的终点结果转化为单个的二分类事件终点。(3)个体化的终点,即在同一个临床试验中,不同的患者可能有不同的终点测量,通常是描述性的探索性终点。例如,在医疗实践中,对于重症患者,医生可能根据每个患者的病理生理学等特征,为每个患者制定个性化的治疗和护理目标。构建个体化终点的过程应该是标准化的,结果评估的标准应该在不同的中心和患者之间保持一致。(4)不同COA类型的汇总评分,例如,在儿童试验中使用PRO和ObsRO相结合的形式。(5)相同COA工具的不同收集形式的汇总评分,例如来自电子设备、纸质、访谈的信息。
4.4 其他考虑
为解释COA终点的结果,申办者应提出适当的阈值(例如,分数变化的范围),以体现目标人群中具有临床意义的个体水平的变化,而不仅是统计学的显著性。这一阈值的大小同样需要以相关指南、专家共识等公认的标准和患者体验数据为基础。
评估COA的度量性能包括其信度、内容/结构效度以及检测变化的能力,对于已建立或重新开发的COA都很重要,尤其对于COA用于主要终点或共同主要终点的情况。探索性研究是检查COA度量性能的最佳时机,从而更好地选择和/或完善COA以便将其带入关键试验。
试验方案中应预先明确定义COA的要素,包括概念、COA 测量工具、计量方式、终点类型和有临床意义的阈值等。
5.在安全性监测中纳入患者体验
药物的安全性风险是患者选择药物时考虑的重要因素之一。在前期收集患者体验数据的研究中,可以了解患者对于特定不良反应的看法和耐受程度,在临床试验设计中重点收集患者关注、耐受度较差从而影响其依从性的事件,尤其对于毒性较大、用药疗程长的药物。在适当的场景下,也可使用COA评估试验药物的安全性和耐受性。例如,在评价治疗慢性肾病贫血药物的安全性风险时,纳入主要心血管不良事件(心血管死亡、心肌梗死和卒中)作为安全性终点。关注症状性不良事件的评估(如恶心、疼痛等),可以选择PRO测量,以直接反映患者的感受。例如,使用SF-36健康调查简表、流调中心用抑郁自评量表(center for epidemiologic studies depression scale,CES-D)等评估接受抗HIV感染联合治疗患者的神经精神反应和睡眠情况等。
临床试验设计中应体现有效的风险管理,以保障受试者安全。尤其对于特殊人群、安全性风险较高的人群,必要时考虑针对性的风险管理措施,包括完善必要的评估检查,在给药和随访过程中设置适当的监测项目与频率,以及针对性的预防/处理方法和随访计划等。例如,肝肾功能损伤患者,可能需要试验药物的剂量调整,以及设置更严格的监测计划和停药标准;对于HIV感染患者,需要充分、动态评估其免疫功能等。
(四)早期与审评机构沟通
为更好地开展以患者为中心的临床试验,在药物研发过程中,申办者应积极与审评机构就重大问题进行沟通交流。应关注以下要点:
1.关键临床试验的主要终点应用COA的合理性与可行性
申办者应在药物研发的早期确定是否计划在其临床试验中使用COA,并与审评机构讨论COA 应用策略。通过前期收集的患者偏好数据和其他信息,或探索性阶段的COA初步评估结果,论证COA作为关键试验主要终点的合理性和可行性。鼓励申办者尽早向审评机构提供COA的关键信息,在关键临床试验开始前得到审评机构反馈,包括预期用途和试验终点的描述、COA评估工具(当前的草案版本,或将在临床试验中实施的最终版本)、COA的评估内容、支持内容效度的证据和支持其他度量性能的证据、COA的评分信息和评分解释等。
2.开发与验证COA
申办者应与审评机构沟通以下关键问题:(1)COA是否适用于预期用途。应与审评机构充分沟通目标疾病的特征,说明计划使用COA评估的内容。(2)COA是否能有效且可靠地评估与临床相关、对患者重要的指标。应说明COA的预期应用场景,包括研究阶段、试验药物的预期获益和风险、目标人群、对照组选择、试验终点等。(3)COA数据是否能以一种准确、可解释的、不产生误导性(即定义明确)的方式呈现。应当向审评机构提供对COA度量性能的评估,包括证实COA的内容效度和结构效度、信度和检测变化的能力等。
四、 结语
本指导原则重点阐述了如何将“以患者为中心”的理念落实到整个临床研发阶段的试验设计中。应将患者需求贯穿药物研发全程,通过调研评估开展收集患者体验数据的研究及研究内容,并采用体现患者需求的临床试验设计。同时,在临床试验中改善受试者体验、减轻受试者负担。
现阶段,落实以患者为中心的临床试验设计可能存在一定的困难与挑战,患者意见是否能够被充分表达且被采纳和执行的环境及措施尚未完全成熟,国外已实行的措施需要结合我国的文化背景、患者接受度等因素逐步推进,实现符合中国国情的以患者为中心的临床试验设计。对于本指导原则未能覆盖的问题,鼓励申请人积极探索可行的方法,积极与审评机构进行沟通交流,在符合科学性的原则下,开展以患者为中心的药物临床试验。未来也将不断地完善和补充本指导原则,进一步深入、具体地展开讨论相关话题。
五、 参考文献
[1] International Council on Harmonisation. E8(R1) Guideline on General Considerations for Clinical Trials. ich.org https://database.ich.org/sites/default/files/E8-R1_Guideline_Step4_2022_0204%20%281%29.pdf (2021).
[2] U.S. Food and Drug Administration. Patient-Focused Drug Development: Selecting, Developing, or Modifying Fit-for-Purpose Clinical Outcome Assessments Guidance for Industry, Food and Drug Administration Staff, and Other Stakeholders (Draft Guidance). fda.gov. https://www.fda.gov/media/159500/download (2022).
[3] U.S. Food and Drug Administration. Discussion Document for Patient-Focused Drug Development Public Workshop on Guidance 4. fda.gov. https://www.fda.gov/media/132505/download (2019).
[4]国家药品监督管理局. 罕见疾病药物临床研发技术指导原则(2021). https://www.cde.org.cn/zdyz/domesticinfopage?zdyzIdCODE=80595fbe5802cf1b95f2246a67b2896d
[5]国家药品监督管理局. 患者报告结局在药物临床研发中应用的指导原则(2022). https://www.cde.org.cn/zdyz/domesticinfopage?zdyzIdCODE=8a900c1173e7aaf72ea3724796cebbeb
[6] International Council on Harmonisation. E7 Studies in Support of Special Populations: Geriatrics
[7] U.S. Food and Drug Administration. Enhancing the Diversity of Clinical Trial Populations — Eligibility Criteria, Enrollment Practices, and Trial Designs Guidance for Industry. fda.gov. https://www.fda.gov/regulatory-information/search-fda-guidance-documents/enhancing-diversity-clinical-trial-populations-eligibility-criteria-enrollment-practices-and-trial (2020).
[8] U.S. Food and Drug Administration. Cancer Clinical Trial Eligibility Criteria: Brain Metastases. fda.gov. https://www.fda.gov/regulatory-information/search-fda-guidance-documents/cancer-clinical-trial-eligibility-criteria-brain-metastases (2020).
[9] U.S. Food and Drug Administration. Cancer Clinical Trial Eligibility Criteria: Patients with HIV, Hepatitis B Virus, or Hepatitis C Virus Infections. fda.gov. https://www.fda.gov/regulatory-information/search-fda-guidance-documents/cancer-clinical-trial-eligibility-criteria-patients-hiv-hepatitis-b-virus-or-hepatitis-c-virus (2020).
[10] U.S. Food and Drug Administration. Cancer Clinical Trial Eligibility Criteria: Patients with Organ Dysfunction or Prior or Concurrent Malignancies. fda.gov. https://www.fda.gov/regulatory-information/search-fda-guidance-documents/cancer-clinical-trial-eligibility-criteria-patients-organ-dysfunction-or-prior-or-concurrent (2020).
[11]国家药品监督管理局. 药物临床试验富集策略与设计指导原则(试行)(2020). https://www.cde.org.cn/zdyz/domesticinfopage?zdyzIdCODE=dae0b296a6ca491b977434b1ad220936
[12] Kartolo A, Gyawali B. Should the control arms of randomized trials have an expiry date? Nat Rev Clin Oncol 2022; : 1–2.
[13]国家药品监督管理局. 抗HIV感染药物临床试验技术指导原则(2021). https://www.cde.org.cn/zdyz/domesticinfopage?zdyzIdCODE=57e99f1ea57773db428c0f27507554de
[14] U.S. Food and Drug Administration. DDT COA #000005: Diary for Irritable Bowel Syndrome Symptoms – Constipation (DIBSS-C). fda.gov. https://www.fda.gov/drugs/clinical-outcome-assessment-coa-qualification-program/ddt-coa-000005-diary-irritable-bowel-syndrome-symptoms-constipation-dibss-c (2021).
[15] 国家药监局药审中心.克罗恩病治疗药物临床试验技术指导原则(2021)https://www.cde.org.cn/main/att/download/506485b4cbb2fe8e45d5307fcaf43aa5
[16] 国家药监局药审中心.溃疡性结肠炎治疗药物临床试验技术指导原则(2021)https://www.cde.org.cn/main/att/download/d2e6cd9c9ff14ebaa6d1db45b64f9181
[17] U.S. Food and Drug Administration. Eosinophilic esophagitis: developing drugs for treatment guidance for industry. https://www.fda.gov/media/120089/download
[18] Iwashyna, T. J. & Deane, A. M. Individualizing endpoints in randomized clinical trials to better inform individual patient care: the TARGET proposal. Crit Care 20, 218 (2016).
[19]张福杰,谢锋.患者报告结局在人类免疫缺陷病毒感染临床研究与实践中的应用进展[J].中华传染病杂志,2021,39(03):129-135.
[20] Basch E. The missing voice of patients in drug-safety reporting. N Engl J Med 2010; 362: 865–9.
[21] Di Maio, M., Basch, E., Bryce, J. & Perrone, F. Patient-reported outcomes in the evaluation of toxicity of anticancer treatments. Nat Rev Clin Oncol 13, 319–325 (2016).
[22] Dueck, A. C. et al. Validity and Reliability of the US National Cancer Institute’s Patient-Reported Outcomes Version of the Common Terminology Criteria for Adverse Events (PRO-CTCAE). JAMA Oncol 1, 1051–1059 (2015)
[23] Pozniak, A. et al. Switching to coformulated elvitegravir, cobicistat, emtricitabine, and tenofovir versus continuation of non-nucleoside reverse transcriptase inhibitor with emtricitabine and tenofovir in virologically suppressed adults with HIV (STRATEGY-NNRTI): 48 week results of a randomised, open-label, phase 3b non-inferiority trial. The Lancet Infectious Diseases 14, 590–599 (2014).
“以患者为中心”的药物研发是指以患者需求为出发点、视患者为主动参与者、以临床价值为最终目的,该理念已成为当前药物研发的核心指导思想。为了实施更加患者可及、友好、便利的临床试验,药品审评中心组织起草了《以患者为中心的临床试验实施技术指导原则》的征求意见稿。
我们诚挚欢迎社会各界对征求意见稿提出宝贵意见和建议,并及时反馈给我们,以便后续完善。征求意见时限为自发布之日起1个月。
您可将意见发到中心联系人的邮箱。
联系人:钱思源 赵聪
邮箱:qiansy@cde.org.cn,zhaoc@cde.org.cn
感谢您的参与和大力支持。
国家药品监督管理局药品审评中心
2022年8月9日
以患者为中心的临床试验实施技术指导原则
一、 引言
作为药物临床试验的受试者和医疗实践的对象,患者对疾病状态和治疗有亲身体会,可为药物研发提供更贴近患者群体期望、有价值的信息。“以患者为中心”的药物研发是指以患者需求为出发点、视患者为主动参与者、以临床价值为最终目的,该理念已成为当前药物研发的核心指导思想。各国审评机构均在探索如何设计和实施“以患者为中心”的药物临床试验,并将患者的需求纳入到药物的获益-风险评估体系中。
患者体验数据(patient experience data, PED)是指所有由患者端(但不仅限于患者本人)提供的有关患者对疾病和相关治疗的经验、需求、观点和偏好等信息。以患者为中心的临床试验实施,重视患者在实施过程中的体验,在合规且可行的范围内提高患者参与临床试验的便利度、减轻患者参与临床试验的负担,实施更加患者可及、患者友好、贴近真实诊疗场景的临床试验。
本指导原则旨在阐明,如何实施以患者为中心的临床试验,包括一般原则、受试者招募、知情同意、访视、给药、安全性监测与报告、数据采集、监查、报销和补偿等环节中的考虑及其他注意事项,提出实施以患者为中心的临床试验时,可能会面临的风险及相关考量。
本指导原则仅代表药品监管部门当前的观点和认识,不具有强制性的法律约束力。随着科学研究的进展,本指导原则中的相关内容将不断完善与更新。应用本指导原则时,请同时参考药物临床试验质量管理规范(GCP)、国际人用药品注册技术协调会(ICH)和其他已发布的相关指导原则。
二、 一般原则
临床试验实施应严格遵循GCP的基本原则,即保护受试者权益和安全及保证数据和结果的科学、真实、可靠。在实施以患者为中心的试验时,应重点关注以下三个方面。
1.改善受试者体验、减轻受试者负担
以患者为中心的临床试验实施,旨在力求改善受试者体验,减轻受试者负担,贴近真实诊疗实践。可根据研究人群、研究药物和试验的特点,采取可靠的新技术、新方法,实施新型临床试验模式。例如,去中心化临床试验(Decentralized Clinical Trial, DCT)指以患者为中心的,不局限于传统临床试验实施现场,场景可选的新型临床试验模式。
2.受试者安全和权益的保护
在改善患者体验、减轻患者负担而采用一些新技术、新方法、新模式时,应重点关注其可能引入的对受试者安全和权益损害的额外风险,例如采用数字化技术伴随的安全性风险及个人隐私泄露风险。
3. 保证数据的质量
同样,在采用一些新技术、新方法、新模式改善患者体验、减轻患者负担时,也应关注可能带来的对数据质量的挑战和影响。例如,远程访视的方式下所采集的数据是否可以保证其真实性、可靠性和完整性;当数据来自不同来源时,如何保证所采集数据的一致性、完整性及可溯源性,以及如何进行评估和分析。
三、 临床试验实施中的考虑
(一)整体实施计划的考虑
为避免盲目追求实施新技术、新方法、新模式,在开始实施临床试验之前,研究团队应充分探讨采用的合理性和必要性,避免为研究带来额外的负担而影响了试验的开展。可根据受试者人群特点、疾病特点、试验特点、药物类型、现有条件和不确定因素,以及患者的接受度来进行探讨。对于所采用的新技术、新方法、新模式,应对其风险进行充分的评估和论证。
临床试验实施中可以完全采用新模式,也可以在一个或多个环节(而非全部)中采用新模式。在某些特定情况下,在提供新技术、新方法、新模式的同时也可提供传统方式作为选择。
在临床试验实施过程中,应基于不断积累的PED,对实施模式进行必要的调整。鼓励申办者在实施前及实施过程中,就所采用的技术或方式及时与审评机构进行沟通。
(二)试验实施具体环节中的考虑
1.基于患者需求的招募
应尽可能的让有需求的受试者发现合适的临床试验,并保证基于潜在受试者的需求和最佳获益风险考虑而入组。
为了让有需求的受试者发现合适的临床试验,可以考虑采用互联网平台招募、基于患者信息大数据的智能化招募等方式。采用互联网平台招募时应考虑不经常上网的人群的需求,确保不会导致招募人群产生选择偏倚。招募内容避免具有煽动性和诱导性。采用基于患者信息大数据的智能化招募等方式时,对潜在受试者的数据来源和使用应符合相关法律法规,筛选和招募的数据范围以及这些数据可共享的范围应提前明确。受试者个人信息应进行一定程度的去标识处理,避免受试者隐私泄露,保证数据安全。
不论采用何种方式的招募,均应基于潜在受试者最佳获益风险考虑而入组,关注对于入排标准的研判,避免为了加快入组速度,而入组获益风险比不佳的受试者。
2. 患者易于接受的知情同意
知情同意为保障受试者权益的重要环节。应从受试者角度出发,采用受试者易于接受的内容和方式,保证受试者充分理解临床试验中的获益和风险,并自愿做出选择和决定。
为了使受试者充分理解知情同意的内容,保障受试者的权益,可考虑采用电子知情的方式,例如,可根据受试者特点选择视频讲解等多媒体方式。为了满足受试者需求,不受限于时间和场所,可考虑采用远程知情的方式。
当试验采用电子知情或远程知情方式时,为了避免不熟悉电子方式的受试者(例如,老年人群)的权益受损,应提前对受试者进行充分说明,也可同时提供传统方式供受试者选择。当采用远程知情方式时,研究者应关注与潜在受试者的实时沟通,保证其在远程条件下充分理解内容。同时应保证知情同意过程和所产生信息的保密性。电子或远程知情同意的记录应留存并可溯源。
对于临床试验所采用的新技术、新方法(例如数字医疗技术[Digital Health Technology, DHT])的使用方式、获益和潜在风险,应在知情同意中充分告知。为了保证个人隐私数据得到保护,应在知情同意中告知其技术或方法所采集的受试者数据可被访问的权限及可被访问的时间范围。为了避免受试者的权益受到损害,对未来可能用于目前临床试验之外的使用范围和可能的获益及风险,应采用泛知情的形式充分告知,并征得其同意,同时需告知受试者即使不同意泛知情,也不会影响受试者的诊疗。此外,当这些技术或方法出现更新或数据采集范围出现变更时,应及时进行新的知情同意过程。
3. 场景可选的访视
临床试验中的访视包括诊疗、样本采集、检查检验、输注给药等内容,是采集受试者真实可靠的有效性和安全性数据的重要环节。应在合规且可行的范围内,为受试者减轻负担、提供便利、改善受试者的体验。
在考虑访视的内容时,为了减轻受试者的负担,应基于受试者特点、试验设计、潜在安全性风险等因素,合理安排每次访视的时间点和内容。在考虑访视的方式时,在可以保证受试者的权益和安全、可保证访视所产生数据真实、可靠、可溯源的情况下,可以考虑提供一些场景可选的访视方式,例如受试者家中上门访视或居住地附近医疗机构进行访视等,提高受试者对访视的可及性,并提供便利。方案中应清晰阐明对于哪些访视、在何种情况下可以采用可选的访视方式。对每次访视方式的安排应具有充分的合理性。
采用电话、视频等方式进行远程访视时,应关注远程条件下受试者的权益和安全得到保护。例如,应保证受试者在远程条件下也可得到合适的治疗和护理;研究者应关注远程条件下受试者的安全性事件监测,提前对安全性事件进行风险预估并建立应急处理计划。为了数据的质量和完整性,诊疗过程及所产生数据需要被恰当、如实、完整记录。如采用远程访视平台,应在经过验证的远程视频平台开展。
采用上门访视或居住地附近访视的方式时,为了保证受试者的安全及数据的科学、真实、可靠,应确保该医疗机构,包括其设备和人员,均经过了相应评估和资质认可,可执行临床试验相关职责和功能。操作人员应由研究者授权,且具有相应专业资质并接受了培训。不论何种访视方式,其诊疗及检查检验结果应及时传输给研究者以进行充分的评估,避免受试者承担不必要的风险。此外,应确保患者的隐私被有效保护,防止个人信息和数据被泄露,确保该访视原始数据的保存及可溯源。
当检查检验的数据来自不同医疗机构时,可能会影响数据结果的质量和一致性,应予以特别关注。应结合数据的重要性、风险、数据结果精确度要求等(例如作为疗效结果的影像学检查结果为关键数据、要求数据结果精确度高),结合研究方案及研究者评估意见确认是否接受非研究中心数据。如在家中或居住地附近进行采样后需进行运输,运输过程中应保证所采集样本的质量。样本采集的过程及其管理需遵循现行相关法律法规的要求。
4.药物直达患者
以患者为中心的给药和治疗中,应尽量减轻受试者的负担,为受试者提供便利,使治疗更加回归真实医疗实践,同时关注其用药安全性和依从性。
对于一些可口服的药物或可在家自行给药的药物,可以考虑采用药物直达患者(Direct to Patient, DTP)的方式,将研究药物直接配送至受试者端,并在受试者根据方案服药之后将剩余药物收回。对于一些静脉输注的药物等需要医护人员操作的药物,在特定情况下,可以通过DTP方式结合上门访视的方式,在受试者家中进行治疗给药(可参考“访视”部分)。在考虑是否采用DTP方式时,除了一般考虑要素之外,还应考虑研究药物的安全性特征(例如安全性特征是否明确、出现SAE风险的大小)、存储条件、给药条件(例如,是否需要提前在无菌环境配置)、受试者地理位置等。
采用DTP方式时,首先应关注受试者的安全性风险。研究者应根据每个受试者的情况,保证受试者充分了解如何服用药物及如何存储药物,尤其对于性质复杂、需要额外操作的研究药物。为了降低受试者出现AE未及时处理而导致的安全性风险,研究者应提前告知受试者并保证其充分理解可能出现的安全性事件(例如过敏反应)及相应的应对计划。
采用DTP方式时,也应关注受试者依从性降低带来的风险。建议研究者对受试者定期进行随访,并计数返还的药物数量,以保证受试者持续的按照要求服用药物。此外,采用DTP方式时,还应对研究药物的质量进行全流程的控制,保证药品在运输和储存过程中的质量,例如运输过程中应进行温度控制、应保证受试者熟悉了解药物在家中的保存条件和规范等。
5. 采集来自患者的数据
1)患者体验数据(PED)的采集
PED为临床试验设计及获益-风险评估提供重要的科学依据(请参考《以患者为中心的临床试验设计指导原则》、《以患者为中心的临床试验获益-风险评估指导原则》)。在以患者为中心的临床试验实施中,应完整、如实、有效地采集PED,并将其及时反馈帮助优化试验设计。患者可以提供对疾病和治疗的需求和体验等PED,也可能在具体试验中提供用作有效性或安全性评价的临床结局评估(Clinical Outcome Assessment, COA)。
对于提供患者需求和体验信息的PED的收集研究,可能会采集患者的额外个人信息,应关注过程中采集的患者个人隐私数据的去标识及保护。对于收集PED的研究的其他注意事项,请参考《以患者为中心的临床试验设计指导原则》、《组织患者参与药物研发的一般考虑指导原则(征求意见稿)》。
对于提供患者有效性或安全性评价信息的COA,实施过程中有如下考量点。首先,COA的评估频率及评估持续时间应与疾病或症状的自然过程、研究目的、试验持续时间相符。评估时间点等流程设计应合理,尽量减少受试者的负担,同时可通过设置提醒和补填等功能,以减少数据缺失。其次,可根据疾病适应症及人群特点,选择合适的COA方式(纸质或电子)、设备及版本。在特定情况下,可在提供电子COA的基础上提供纸质COA供受试者选择。最后,应保证COA结果均由具有相应资质的研究人员进行评估。
电子化COA(eCOA)具有可采集实时、真实的数据,数据转录容易等优势,可以结合可穿戴设备或移动电子平台(如手机app)实施,为受试者提供便利。经评估,可由纸质COA转至电子化COA,转移时应实施有效的方法测试两种管理模式的测量等效性。所采用的电子设备应经过验证,所采集的eCOA数据应符合纸质COA的要求,应确保满足监管机构对于记录保存、维护和访问的要求。此外,应保护所采集受试者的隐私数据。
2)数字医疗技术(Digital health technologies,DHT)的应用
数字医疗是把现代计算机技术、信息技术应用于整个医疗过程的一种新型的现代化医疗方式,可应用移动医疗(例如移动/可穿戴设备)或远程监护(智能检测/监测设备)对受试者信息(包括实时的体征、用药依从性等)进行远程收集。应用远程DHT设备可直接收集来自受试者真实生活中的更加全面而多维的数据,减少了人工输入的流程,采集到的数据质量较高。
在选择DHT时,应选择适合目的(fit-for-purpose),适合受试者使用的DHT,需考虑的因素包括疾病特征、研究人群(包括研究人群的教育、语言、技术能力等)、试验设计、DHT的特征等。此外,还应考虑是否可使用受试者自己的DHT(例如,连续葡萄糖监测仪)和/或通用计算平台(例如手机、平板电脑)收集数据。
DHT使用前申办者需对临床研究过程中涉及的计算机化系统进行验证,对数据的初始输入和任何后续更改要保持稽查轨迹。临床试验开始前,也需要对DHT方法应用进行确认和验证及可用性研究,例如通过检查确认DHT可以在目的人群中恰当地评估临床事件或特征(如步数或心率)。
DHT的使用,可能会给受试者带来额外的临床风险。应进行适当的安全性测试,以评估DHT的物理特征可能引起的损伤风险(例如,腕带阻断血液供应,皮肤刺激等)。使用DHT采集数据前,还应进行受试者身份识别(面部/指纹/身份证等),确保设备采集的数据为受试者本人。为了充分保护受试者的个人隐私数据,应确保数据安全保障措施到位。
DHT的采用,应关注对数据质量带来的影响,应保证所采集自患者的数据的可溯源性。采用DHT时,如使用不同设备或技术平台(包括患者自己的移动设备)收集数据,应考虑数据和结果的一致性。DHT和通用计算平台的错误(如涉及电池、传感器等)可能会导致数据丢失或损坏,应制定相应应急计划。DHT设备和技术平台也可能进行更新迭代,对数据一致性和结果分析带来挑战。
在提交审评机构的DHT相关资料中,申办者应描述DHT的基本信息,包括DHT的相关物理特征,数据输出,以及DHT如何采集临床事件或感兴趣的特征的信息(例如使用脉搏仪来计数心跳)。应描述与可用性相关的特征(如DHT如何佩戴、操作和充电),以及如何控制访问DHT或从DHT收集的数据,以确保隐私和安全。申办者还需对数据管理的信息进行描述,包括数据的收集、存储、传输和归档,以证明临床研究过程中数据采集的完整性和一致性。
6. 及时的安全性监测和报告
安全性监测和报告为保证受试者安全的重要一环。通过纸质日记卡让受试者自行采集安全性事件信息,并在下次现场随访时与研究者沟通的方式,通常依从性较低,且采集到的数据有限。可以考虑采用一些数字化的技术和平台(例如通过受试者的手机app或远程访视平台)和/或数字医疗技术(例如可穿戴设备),可以对受试者的安全性进行实时的监测及报告,使受试者更方便的上报安全性事件,提高依从性,采集更为实时且真实的安全性数据,并直接传递给研究者。
采用这些技术时,应关注可能会带来的额外的安全性风险。研究者可以通过平台实时接收受试者的安全性信息(例如AE),但研究者会综合考虑研究药物的安全性特征、团队资源等,合理安排对这些报告的查看频率并进行处理。因此研究者接收和评估受试者的安全性信息,会存在一些时间上的延迟。为了避免研究者未及时查看而导致受试者承受安全性风险,研究者应提前明确告知受试者这种情况,并告知受试者在何种情况下(例如出现SAE时),受试者可以直接联系研究者(例如,通过电话)。此外,当发生严重事件(例如SAE)时,该平台应建立机制,保证可以通过触发机制直接联系研究者,可以使其在规定时限内查看评估并报告给申办者。最后,通过技术和平台收集的受试者的个人信息,应予以充分保护。
7. 远程监查
监查为临床试验质量管理活动中的重要部分。远程监查是指由申办者工作人员或代表在实施临床研究的中心之外的地方,主要通过源文件查阅的方式,对试验数据进行审查。目前很多临床试验实施采用数字化系统和平台,采集到的源数据以电子形式储存,为实施远程监查提供了可能。
考虑是否采用远程监查的方式,以及对供查阅的源数据建立远程访问权限时,应综合考虑其必要性和合理性,包括考虑受试者电子源数据是否可及、远程监查与现有系统、平台及流程的兼容性、研究团队的经验和可承受的负担等条件而决定。盲目开展远程监查可能为研究中心带来不必要的负担,且无法达到有效监查的目的。
采用远程监查时首要关注的是,受试者个人信息的保护以及数据的安全性。为了保护个人信息及防止数据泄露,对来自各种电子化系统(例如医院病历系统)的源数据进行远程监查时,应对源数据进行数据加密或去标识化的措施,并对各个系统的访问权限、访问范围(如仅可访问参与临床试验的患者数据、仅具有可读功能)等进行规定。同样,为了保证数据安全,远程监查中所使用的远程监查平台,应经过验证,并设置登录验证流程,以保证进入远程监查系统访问源数据的人员的身份。远程监查员应在保密性好且安全的网络环境下进行远程监查。此外,使用远程监查系统的人员需要经过相应的培训,所有监查记录应完整留存。
8. 受试者的报销和补偿
对受试者因参与临床试验而产生的实际花费和支出应当予以报销,其金额应当与支出相同。对受试者参与临床试验花费的时间和给其带来的不便,应当给予补偿,其补偿方式、数额和计划需要通过伦理审查并体现在知情同意书中。除现金补偿外,也可考虑其它符合患者需求的多种补偿形式。申办者和研究者应当及时兑付给予受试者的报销和补偿。
为了实现“及时兑付”,切实保障受试者的权益,受试者补偿和报销,可考虑选择结合新技术的支付方式来实现。如采用新的支付方式,应符合现行法律法规,特别关注个人信息的保护。
四、 其他注意事项
(一) 加强多方沟通
1. 加强与受试者的沟通
与受试者建立良好信任关系为进行以患者为中心的试验实施的基石,当采用远程方式时(例如远程访视),应尤其关注建立良好的医患关系。和受试者的沟通及对受试者的关怀应贯穿试验的全过程,应及时听取受试者的声音,了解受试者的需求。
2. 加强团队各方的沟通
应加强申办者、研究者、CRO之间的沟通,基于实施中实时采集的患者体验数据,应及时沟通并做出相应试验调整或临床决策。采用新技术、新方法、新模式时,应加强与授权的研究人员(例如进行居住地访视的医护人员)之间的沟通,保证试验顺利实施。当出现安全性问题时,应及时和伦理委员会沟通。
3. 及时与审评机构沟通
采用一些新技术、新方法、新模式时,应就使用目的、使用场景、基本信息、评估与验证数据、与传统方式的对照试验数据、风险评估及缓解措施等等,及时和审评机构进行沟通。
(二) 教育和培训
1. 研究人员的培训
应对参与试验的研究人员,尤其是针对所采用的新技术、新方法、新模式的使用方法、注意事项、潜在风险及处理等进行培训。应对授权的远程研究人员或居住地附近访视的研究人员进行教育和培训,保证其充分理解研究方案、实施操作及潜在风险。此外,也应通过培训提高对患者体验数据采集及反馈的重视。
2. 受试者的培训和教育
作为重要的试验参与方,应提前对受试者进行培训和教育。应鼓励受试者及时并如实表达对疾病和治疗、临床试验实施的意见和需求。应对受试者进行充分的教育和培训,使其充分理解临床试验实施中所采用的新技术、新方法、新模式(例如试验中采用的eCOA、DHT)的具体使用方法、注意事项、数据的记录和留存、获益与潜在风险、出现安全性事件时的处理措施等内容,保障患者的权益和安全,提高受试者依从性。
五、结语
以患者为中心是当前药物研发的核心理念。以患者为中心的临床试验实施,旨在改善受试者的体验、减轻受试者参与临床试验的负担,可采用一些新技术、新方法、新模式,同时应保证这一过程中受试者的权益和安全,以及数据的科学、真实、可靠。
实施过程中采用的很多新技术、新方法、新模式目前尚在不断开发和完善的过程中,有些尚需积累经验和数据,其风险特征尚待明确。随着科学技术的不断发展,未来也会不断出现新的技术和方法,及新的风险和不确定性,为临床试验实施提出的新的困难和挑战。
鼓励各方继续探索和开发可支持以患者为中心的试验实施的新技术、新方法、新模式,同时建议各方持续对这些不断涌现的新风险进行识别、评估、管理,并及时与审评机构进行沟通和交流。未来也将不断地完善和补充本指导原则,进一步深入、具体地开展相关话题的讨论。
六、参考文献
[1]NMPA,《药物临床试验质量管理规范》,2020
[2]CDE,《新冠肺炎疫情期间药物临床试验管理指导原则(试行)》,2020
[3]CDE,《患者报告结局在药物临床研究中应用的指导原则》,2021
[4]CDE,《临床试验的电子数据采集技术指导原则》,2016
[5]CMDE,《人工智能医疗器械注册审查指导原则》,2022
[6]张 菁,李高扬.远程智能临床试验专家共识[J/OL].中国新药与临床杂志. https://kns.cnki.net/kcms/detail/31.1746.r.20220616.0946.002.html.
[7]《远程智能临床试验》 编委会,《远程智能临床试验》,2022(待出版)
[8]FDA. Conduct of Clinical Trials of Medical Products During the COVID-19 Public Health Emergency:Guidance for Industry, Investigators, and Institutional Review Boards,2021
[9]EMA. GUIDANCE ON THE MANAGEMENT OF CLINICAL TRIALS DURING THE COVID-19 (CORONAVIRUS) PANDEMIC[R].2021.
[10]Swissmedic and swissethics. Decentralised clinical trials (DCTs) with medicinal products in Switzerland,2021
[11]DMA. The Danish Medicines Agency’s guidance on the implementation of decentralised elements in clinical trials with medicinal products,2021
[12]FDA. Digital Health Technologies for Remote Data Acquisition in Clinical Investigations:Guidance for Industry, Investigators, and Other Stakeholders,2021

来源:Internet


