您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-10-31 14:43
一、什么叫做医疗器械?
根据《医疗器械监督管理条例》739号令,医疗器械:是指直接或者间接用于人体的仪器、设备、器具、体外诊断试剂及校准物、材料以及其他类似或者相关的物品,包括所需要的计算机软件;其效用主要通过物理等方式获得,不是通过药理学、免疫学或者代谢的方式获得,或者虽然有这些方式参与但是只起辅助作用;其目的是:
(一)疾病的诊断、预防、监护、治疗或者缓解;
(二)损伤的诊断、监护、治疗、缓解或者功能补偿;
(三)生理结构或者生理过程的检验、替代、调节或者支持;
(四)生命的支持或者维持;
(五)妊娠控制;
(六)通过对来自人体的样本进行检查,为医疗或者诊断目的提供信息。
医疗器械种类很多,但我认为主要可以分为治疗类和监测诊断类。
二、医疗器械按照风险程度是如何分类的?
按照风险程度实行分类管理。
第一类是风险程度低,实行常规管理可以保证其安全、有效的医疗器械。
第二类是具有中度风险,需要严格控制管理以保证其安全、有效的医疗器械。
第三类是具有较高风险,需要采取特别措施严格控制管理以保证其安全、有效的医疗器械。
三、我们国家对于医疗器械的备案与注册管理
第一类医疗器械实行产品备案管理。第二类、第三类医疗器械实行产品注册管理。
境内第一类医疗器械备案,备案人向设区的市级负责药品监督管理的部门提交备案资料。
境内第二类医疗器械由省、自治区、直辖市药品监督管理部门审查,批准后发给医疗器械注册证。
境内第三类医疗器械由国家药品监督管理局审查,批准后发给医疗器械注册证。
进口第一类医疗器械备案,备案人向国家药品监督管理局提交备案资料。
进口第二类、第三类医疗器械由国家药品监督管理局审查,批准后发给医疗器械注册证。
四、医疗器械临床评价
医疗器械临床评价是指采用科学合理的方法对临床数据进行分析、评价,以确认医疗器械在其适用范围内的安全性、有效性的活动。
有下列情形之一的,可以免于进行临床评价:
(一)工作机理明确、设计定型,生产工艺成熟,已上市的同品种医疗器械临床应用多年且无严重不良事件记录,不改变常规用途的;
(二)其他通过非临床评价能够证明该医疗器械安全、有效的。
除了免于进行临床评价的产品,开展医疗器械临床评价,可以根据产品特征、临床风险、已有临床数据等情形,通过开展临床试验,或者通过对同品种医疗器械临床文献资料、临床数据进行分析评价,证明医疗器械的安全性、有效性。
2021年9月16日,NMPA发布国家药监局关于发布免于临床评价医疗器械目录的通告(2021年第71号)》,1010款免于临床评价医疗器械目录发布。
2022年5月-7月,CMDE分别发布了《医疗器械分类目录》子目录01-22的相关产品临床评价推荐路径。
五、临床试验前开展的工作
5.1基于产品技术要求的产品检验报告
注册检验是指国家药品监督管理局(NMPA)认可的、具有医疗器械检验资质、且检验项目在其承检范围内的医疗器械检测机构,依据产品技术要求对申报产品进行全项目检验,并出具检验报告。注册检验属事业性质,不收取任何费用,但需排队候检,周期慢且无法确定,依据检测机构目前承接项目预计周期。其报告具有权威性,并能获得药监部门的认可。
委托检验是企业委托药监认可的检测机构或者第三方检测机构,依据标准和产品技术要求对产品安全性有效性做出技术评价,并取得检验报告的过程。委托检验具备商业性质,收取加速检测的费用,周期相对普通的注册检验较快。委托的检验机构不限于药监系统,第三方有检验检测机构资质认定证书及CMA资质,且承检范围内有对应标准的都可以。
注册自检是医疗器械注册申请人按照产品技术要求,自行对其申报的产品进行全项目检验,并出具自检报告。注册申请人开展自检工作,包括自己公司检测、委托受托生产企业检测,这些都不需要任何资质,但应具有产品技术要求中相应的自行检验能力,包括具备相应人员、设备、设施和环境等,并按照质量管理体系要求开展检验。自检工作将会纳入医疗器械质量管理体系核查中。
5.2动物实验
医疗器械安全性和有效性评价研究应采用科学、合理的评价方法,其中动物试验是重要手段之一,其属于产品设计开发中的重要研究,可为产品设计定型提供相应的证据支持;若需开展临床试验,可为医疗器械能否用于人体研究提供支持,降低临床试验受试者及使用者的风险以及为临床试验设计提供参考。
但并不是所有医疗器械均需要通过动物试验验证产品安全性和有效性。为了对开展动物试验的必要性判定提供指导,减少动物试验研究数量,避免开展不必要的动物试验。
六、临床试验定义
医疗器械临床试验是指在经资质认定的医疗器械临床试验机构中,对拟申请注册的医疗器械在正常使用条件下的安全性和有效性进行确认或者验证的过程。
6.1医疗器械GCP发展历史
《医疗器械临床试验规定》局令5号,自2004年4月1日起施行,一直到2016年6月1日《医疗器械临床试验质量管理规范》(第25号令)的颁布之前,作为医疗器械临床试验执行的规范,同时也要确保符合《药物临床试验质量管理规范》的要求。
2016年6月1日《医疗器械临床试验质量管理规范》(第25号令)颁布,至2022年5月1日新版《医疗器械临床试验质量管理规范》的颁布期间,执行《医疗器械临床试验质量管理规范》(第25号令)的规定。
2022年5月1日,执行新版《医疗器械临床试验质量管理规范》。
6.2临床试验中心的筛选
2004年开展医疗器械临床试验,根据《医疗器械监督管理条例》第276号,由国务院药品监督管理部门会同国务院卫生行政部门认定的药物临床试验机构开展。从2004年-2018年,医疗器械临床试验一直在药物临床试验机构开展。2018年1月1日,《医疗器械临床试验机构条件和备案管理办法》实施了,鼓励医疗器械临床试验机构备案。申请医疗器械临床试验的机构自2018年1月1日起开始进行备案。同时,设定了一个缓冲期。自2018年1月1日至2018年12月31日,医疗器械临床试验申办者可以继续选择药物临床试验机构开展临床试验。但自2019年1月1日起,应当选取已经在备案系统备案的医疗器械临床试验机构。据西格玛医学内部调查,截止2022年10月,全国已经有1184家医疗器械临床试验机构备案,包含了省部级医院,市级医院,县级医院,均为二级甲等及以上的级别医院。
6.3临床方案设计
临床试验设计的基本类型和特点
(一)平行对照设计
随机、双盲、平行对照的临床试验设计可使临床试验影响因素在试验组和对照组间的分布趋于均衡,被认为可提供高等级的科学证据,通常被优先考虑。
(二)配对设计
对于治疗类产品,常见的配对设计为同一受试对象的两个对应部位同时接受试验器械和对照治疗,试验器械和对照治疗的分配需考虑随机设计。配对设计主要适用于器械的局部效应评价,具有一定的局限性。对于诊断器械,若试验目的是评价试验器械的诊断准确性,常见的配对设计为同一受试者/受试样品同时采用试验器械和诊断金标准方法或已上市同类器械来进行诊断。
(三)交叉设计
在交叉设计的临床试验中,每位受试者按照随机分配的排列顺序,先后不同阶段分别接受两种或两种以上的治疗/诊断。
(四)单组设计
单组试验的实质是将主要评价指标的试验结果与已有临床数据进行比较,以评价试验器械的有效性/安全性。与目标值比较、与历史研究对照。
6.4 临床试验开展前的审批
根据《需进行临床试验审批的第三类医疗器械目录(2020年修订版)》、《第三类高风险医疗器械临床试验审批服务指南》除了应当获得医疗器械临床试验机构伦理委员会的同意外,列入需进行临床试验审批的第三类医疗器械目录的,还应当获得国家食品药品监督管理总局的批准。与境内外已上市产品相比,采用全
新设计、材料或机理,和/或适用于全新适用范围,且对人体具有较高风险的医疗器械,应当经临床试验审批后方可在中国开展临床试验。
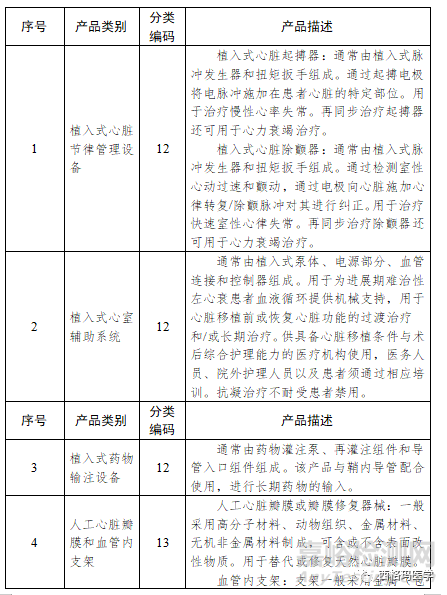
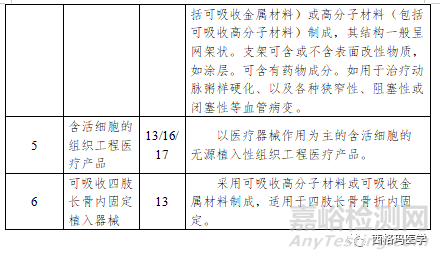
6.5临床试验备案
开展医疗器械临床试验,申办者应当在试验项目经伦理审查通过并与临床试验机构签订协议或合同后,填写《医疗器械临床试验备案表》,提交备案表中列出的相关材料,其中境内医疗器械向申办者所在地省级食品药品监督管理部门备案,进口医疗器械向代理人所在地省级食品药品监督管理部门备案。
6.6临床试验样本量
临床试验收集受试人群中的疗效/安全性数据,用统计分析将基于主要评价指标的试验结论推断到与受试人群具有相同特征的目标人群。为实现样本(受试人群)代替总体(目标人群)的目的,临床试验需要一定的受试者数量(样本量)。样本量大小与主要评价指标的变异度呈正相关,与主要评价指标的组间差异呈负相关。
确定样本量的相关要素一般包括临床试验的设计类型和比较类型、主要评价指标的类型和定义、主要评价指标有临床实际意义的界值、主要评价指标的相关参数(如预期有效率、均值、标准差等)、Ⅰ类和Ⅱ类错误率以及预期的受试者脱落和方案违背的比例等。一般情况下,Ⅰ类错误概率α设定为双侧0.05或单侧0.025,Ⅱ类错误概率β设定为不大于0.2,预期受试者脱落和方案违背的比例不大于0.2,申请人可根据产品特征和试验设计的具体情形采用不同的取值,需充分论证其合理性。
6.7临床试验的现场核查
2015年药物临床试验“722”后,临床试验核查从药物试验延伸至医疗器械临床试验。2016年1月全国医疗器械监督管理工作会议中提出,适时启动医疗器械临床试验数据核查。2016年3月北京市食品药品监督管理局关于开展医疗器械临床试验自查,掀起了医疗器械核查的序幕。随即国家局开展了每年2个批次的临床试验核查,西格玛医学作为首轮被抽中的CRO,凭借坚实的基础,
临床试验数据真实、可靠,完整,顺利通过了核查。2021年后,临床试验的现场核查进入“飞检”模式,不再公告,不允许撤回。
2018年11月发布的《医疗器械临床试验检查要点及判定原则》,对临床试验前准备、受试者权益保障、临床试验方案、临床试验过程、记录与报告、试验用医疗器械管理这六个层面进行了要点描述,根据检查发现,对真实性问题、合规性问题、符合要求也给出了明确的判定原则,也是目前核查的依据。
随着2022年新版GCP的公布,新版的《医疗器械临床试验检查要点及判定原则》相信不久,也会更新发布。

来源:西格玛医学


