今日头条
盛世泰科CDK4/6抑制剂获批血癌临床。盛世泰科基于其专有PD2(精准化抗癌药物开发)平台自主研发的1类新药CGT-1967获国家药监局临床试验默示许可,拟开发用于急性髓系白血病(AML)患者的治疗。CGT-1967是一款差异化CDK4/6抑制剂,在小鼠模型研究中可显著抑制肿瘤细胞在血液、脾脏和骨髓占位,延长动物生存期。CGT-1967有望为血液癌患者提供新的治疗选择。
国内药讯
1.阿斯利康CTLA-4单抗肝癌临床亚洲队列积极。阿斯利康宣布将在ESMO ASIA2022大会上公布其CTLA-4单抗tremelimumab联合PD-L1度伐利尤单抗一线治疗不可切除肝癌Ⅲ期临床HIMALAYA的亚洲亚组积极数据。与索拉非尼单药相比,tremelimumab联合治疗使患者死亡风险降低32%,三年生存率达32.2%,中位总生存期(mOS)达16.5个月,均与全球人群数据一致;在中国香港、台湾地区患者中,tremelimumab联合治疗中位mOS达29.4个月,三年生存率达49.2%,患者的死亡风险降低56%。亚洲亚组中药物的安全性与已知研究一致。
2.天广实CD20/CD3双抗获批临床。天广实生物1类生物制品注射用MBS303获国家药监局临床试验默示许可,拟开发适应症为CD20阳性的B细胞淋巴瘤。MBS303是一款2:1结构CD20/CD3双抗,特殊设计增加了与肿瘤细胞的亲和力,诱导T细胞激活并减少脱靶毒性。天广实计划尽快开展Ⅰ/Ⅱ期临床研究,评价MBS303治疗复发/难治性CD20阳性B细胞非霍奇金淋巴瘤(B-NHL)的安全性、耐受性、PK/PD特征,以及初步疗效。
3.北京中因眼科基因疗法获批BCD临床。中因科技具有独立自主知识产权的基因治疗药物ZVS101e注射液获国家药监局临床默示许可,拟开发用于携带CYP4V2双等位基因突变的结晶样视网膜变性(BCD)。ZVS101e旨在通过rAAV病毒将正常的CYP4V2基因拷贝携带到患者视网膜细胞中,补充视网膜细胞中正常CYP4V2基因的表达量,恢复视网膜细胞功能,以达到治疗的目的。在美国,该产品已获FDA孤儿药资格。
4.博锐CD70单抗报IND。博锐生物1类生物制品BR108注射液临床试验申请获CDE受理。BR108是一款新型CD70单抗,可通过抗体依赖性细胞介导的细胞毒作用(ADCC)、抗体依赖的细胞介导的吞噬作用(ADCP)、补体依赖的细胞毒性(CDC)作用杀伤多种CD70阳性肿瘤细胞;以及通过阻断CD70与其受体CD27的相互作用,解除免疫抑制。该新药拟开发用于治疗CD70阳性血液瘤和实体瘤等适应症。
5.康方PD-1/VEGF双抗海外授权。康方生物宣布就其依沃西(PD-1/VEGF双特异性抗体)与Summit Therapeutics达成许可协议,将授予Summit Therapeutics在美国、加拿大、欧洲和日本开发和商业化依沃西的独家许可权。根据协议,康方生物将获得5亿美元的首付款,可能高达50亿美元的开发、注册及商业化里程碑潜在付款,以及产品的销售分成。康方生物保留依沃西上述地区外的开发和商业化权利。
国际药讯
1.渤健口服抗抑郁新药在美报NDA。渤健与Sage公司开发的新一代GABAA变构调节剂zuranolone(SAGE-217/BIIB125)已完成向FDA滚动提交上市申请(NDA),用于治疗重度抑郁症(MDD)和产后抑郁症(PPD)。在CORAL研究中,Zuranolone联合标准治疗使MDD患者的17项汉密尔顿抑郁量表(HAMD-17)评分在第3天即显示出较安慰剂的显著改善(-8.9±0.39 vs -7.0±0.38,p=0.0004)。在SKYLARK研究中,与安慰剂相比,50mg zuranolone治疗组第15天时HAMD-17评分较基线显著降低(-15.6比-11.6,p=0.0007)。
2.外用JAK抑制剂湿疹Ⅲ期试验积极。LEO Pharma公司JAK抑制剂乳膏delgocitinib治疗中重度慢性手部湿疹(CHE)的Ⅲ期临床达到主要与所有关键次要终点。与溶剂组相比,delgocitinib乳膏组第16周时达成IGA-CHE分数0(清除)或1(几乎清除,微量或无疾病残留),且与基线相较至少有两个级别改善的患者比例更高;而且Delgocitinib在治疗早期便可缓解患者的慢性手部湿疹症状。此外,药物具良好的耐受性。
3.免疫检查点三联疗法临床数据积极。Compugen公司PVRIG抗体COM701联合百时美施贵宝PD-1抑制剂Opdivo(nivolumab)和TIGIT抗体BMS-986207构成的三联方案,在既往大量前期治疗的铂耐药卵巢癌患者中获得积极结果。数据显示,三联疗法达到20%的总缓解率与40%的疾病控制率;而且组合疗法总体耐药性良好。详细数据公布于ESMO-IO2022会议上。COM701与PD-1抗体联用能刺激T细胞产生协同作用,具有进一步增强针对肿瘤的免疫应答的潜力。
4.KRAS抑制剂联合用药肺癌临床积极。Mirati公司KRAS G12C抑制剂adagrasib联合PD-1抑制剂pembrolizumab一线治疗KRAS G12C突变、非小细胞肺癌(NSCLC)的最新临床数据积极。来自Ⅱ期临床KRYSTAL-7和Ⅰb期KRYSTAL-1试验数据显示,中位随访3.5个月时,adagrasib联合pembrolizumab在所有PD-L1亚组中达到的客观缓解率(ORR)为49%。在Ⅰb期KRYSTAL-1试验中,中位随访19.3个月时,ORR为57%,疾病控制率(DCR)为100%。试验中,未观察到4~5级TRAE。再鼎医药拥有该药在大中华区的独家权益。
5.辉瑞合作开发口服新冠PLpro抑制剂。辉瑞宣布与专注于SARS-CoV-2和其他病毒开发小分子抗病毒疗法的Clear Creek Bio公司达成独家许可协议,合作开发SARS-CoV-2木瓜蛋白酶样蛋白酶(PLpro)抑制剂口服候选药物,用于COVID-19治疗。PLpro在病毒复制和介导免疫逃逸起关键作用。根据协议,Clear Creek Bio将收到预付款,潜在里程碑付款以及产品的销售分成。辉瑞将负责合作产品的临床开发和商业化活动。
6.酒渣鼻局部疗法II期研究失败。Dermata公司每周一次的局部疗法DMT310用于治疗中重度玫瑰痤疮(酒渣鼻)的II期临床未达到主要终点。DMT310是一款来自淡水海绵的天然衍生产品,主要有机成分包含在体外测试时显示出对IL-17A和IL-17F的剂量依赖性抑制的化合物。该项数据显示,使用DMT310治疗4次后,患者炎症皮肤面积减少44%,与DMT310治疗痤疮的IIb期研究中看到的炎症皮肤面积减少45%相对应。据悉,该公司计划在2023年启动痤疮的III期研究。
医药热点
1.国务院进一步优化落实防疫防控新十条。12月7日,国家卫健委在官方网站发布《关于进一步优化落实新冠肺炎疫情防控措施的通知》,在落实二十条措施的基础上,进一步优化疫情防控,提出十条新举措。《通知》明确,除养老院、福利院、医疗机构、托幼机构、中小学等特殊场所外,不要求提供核酸检测阴性证明,不查验健康码;感染者要科学分类收治,具备居家隔离条件的无症状感染者和轻型病例一般采取居家隔离。
2.2022年国家医保药品目录现场谈判延期。根据国家医疗保障局网站6日消息,为保证现场谈判平稳有序,综合考虑新冠疫情影响和谈判工作需要,2022年国家医保药品目录现场谈判延期开展。具体时间确定后,将提前一周左右通知各谈判主体。协议将于2022年12月31日到期的目录内谈判药品,原协议有效期自动顺延至新版目录正式实施。
3.河南这类医生可直接注册全科医学专业。近日,河南省卫健委发布关于乡村基层医师注册全科执业范围有关事宜的通知。通知明确,取得乡村全科执业助理医师资格且已在乡镇卫生院或村卫生室注册执业的医生,经考试取得执业(助理)医师资格后再次注册全科医学专业,不需要再进行全科医师培训;持有《乡村医生执业证书》的在岗医生,经考试取得执业(助理)医师资格后在乡镇卫生院或村卫生室注册全科医学专业的,不需要再进行全科医师培训。
评审动态
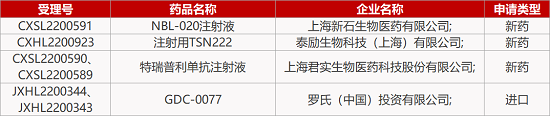
1. CDE新药受理情况(12月07日)
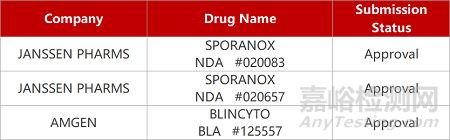
2. FDA新药获批情况(北美12月05日)